
2.在2L密闭容器中进行如下反应:mX(g)+nY(g)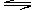 pZ(g)+qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
pZ(g)+qQ(g),2s时间内X表示的平均反应速率为0.3mpmol/(L·s),则2s时间内,Q物质增加的物质的量为
A.1.2qpmol B.1.2mpmol C.1.6pqmol D.0.6qpmol
1.在一定条件下,可逆反应:N2+3H2 2NH3
;ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是
2NH3
;ΔH<0达到平衡,当单独改变下列条件后,有关叙述错误的是
A.加催化剂,v(正)、v(逆)都发生变化且变化的倍数相等
B.加压,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
C.降温,v(正)、v(逆)都减小,且v(正)减小的倍数大于v(逆)减小的倍数
D.加入氩气,v(正)、v(逆)都增大,且v(正)增大的倍数大于v(逆)增大的倍数
4.“惰性”气体对密闭体系中进行的化学反应速率的影响
⑴ 恒温、恒容容器:充入稀有气体或其他不参加反应的气体,虽改变了容器内气体的压强,但却没有改变反应体系的分压,即并没有改变反应物的 ,不影响化学反应速率。
⑵ 恒温、恒压容器:充入稀有气体或其他不参加反应的气体,使容器的容积扩大,虽未减小容器气体的压强,但却减少了反应体系的分压,即降低了 ,故能使反应速率降低。
[典型例题]
[例1]反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010mol·L-1·s-1 B.v(O2)=0.0010 mol·L-1·s-1
C.v(NO)=0.0010 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
[例2]可逆反应aX(g)+bY(g)
4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)(反应物的消耗速率或产物的生成速率)可表示为
A.v(NH3)=0.010mol·L-1·s-1 B.v(O2)=0.0010 mol·L-1·s-1
C.v(NO)=0.0010 mol·L-1·s-1 D.v(H2O)=0.045 mol·L-1·s-1
[例2]可逆反应aX(g)+bY(g) cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(v)一时间(t)图象如右图。则下列说法中正确的是
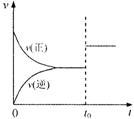 A.若a+b=c,则t0时只能是增大了容器的压强
A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
[例3]某化学反应2A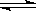 B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为见反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
⑴ 在实验1,反应在10至 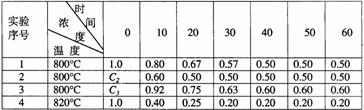 20分钟时间内平均速率为
20分钟时间内平均速率为
mol/(L·min);
⑵ 在实验2,A的初始浓度c2= mol/L,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 ;
⑶ 设实验3的反应速率为v3,实验1的反应速率为v1,则v3 v1(填>、<、=),且c3 1.0mol/L(填>、<、=);
⑷ 比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。理由是 。
[当堂反馈]
3.改变外界条件(浓度、温度、压强、催化剂)对于可逆反应v(正)、v(逆)的影响(利用速率曲线图说明。特别注意,压强的影响结果与可逆反应有无气体参加或反应前后气体体积是否变化有关)。外界条件对于可逆反应v(正)、v(逆)的影响
(1)浓度:增大反应物浓度,v(正) ,v(逆) ;增大生成物浓度,v(逆) ,v(逆) 。
(2)压强:对于有气体参加的反应,增大压强,v(正)、v(逆)均 ,气体体积之和(系数和)大的反应速率增加得 ;降低压强,v(正)、v(逆)均 ,气体体积之和(系数和)大的反应速率减少得 。
(3)温度 :升高温度,v(正)、v(逆)一般均 ,吸热反应增加的倍数 放热反应增加的倍数;降温,v(正)、v(逆)一般均减小,吸热反应减小的倍数 放热反应减小的倍数。
(4)催化剂:能 程度的改变v(正)、v(逆),改变反应到达平衡的 。
3.影响化学反应速率的因素以及微观解释
|
影响因素 |
规
律 |
注 意 点 |
|
|
内 因 |
反应物的结构、性质、反应的历程是决定化学反应速率的主要因素 |
化学反应的实质是旧化学键的断裂,新化学键的生成。若在同样的条件下,反应物分子中化学键越牢固,化学键的断裂就越难,其反应速率就越小 |
|
|
外 因 |
浓 度 |
在其他条件不变时,增大反应物浓度,单位体积内 也相应增大,反应速率
。反之,反应速率减慢。 |
固体物质的浓度恒定,故改变固体物质的用量对反应速率无影响。固体物质对速率的影响只与其表面积的大小和生成物在表面的扩散速率有关。 |
|
压 强 |
在其他条件不变时,对于有气体参加的反应,增大压强,气体的体积减小,浓度增大, 也相应增大,反应速率加快。反之,反应速率减慢。 |
由于压强对固体,液体的体积几乎无影响,因此对于无气体参加的反应,压强对反应速率的影响可忽略不计;恒容时,若充入与平衡体系无关的气体虽总压增大,但各反应物浓度不变,反应速率不变。 |
|
|
温 度 |
在其他条件不变时,升高温度,反应物分子能量增加,从而增大了
,有效碰撞次数增多,反应速率加快。反之,反应速率减慢。 |
一般来说,温度每升高10ºC,反应速率增大到原来2-4倍;对于有催化剂参加的反应,要注意催化剂的活性温度。 |
|
|
催 化 剂 |
在其他条件不变时,使用正催化剂能降低
,增大
百分数,反应速率显著增大。 |
若使用负催化剂,反应速率明显减慢,一般无特殊说明指正催化剂;催化剂具有选择性,反应前后质量与组成保持不变。 |
|
|
其 他 |
光、超声波、紫外线、固体颗粒大小、溶剂等对化学反应速率也有影响。 |
附:外因对化学反应速率影响的微观解释
|
影响因素 |
分子总数 |
活化分子百分数 |
活化分子数 |
单位体积活化分子数 |
|
增大浓度 |
|
|
|
|
|
增大压强 |
|
|
|
|
|
升高温度 |
|
|
|
|
|
正催化剂 |
|
|
|
|
注意:化学反应速率的大小是由单位体积内活化分子数(相当于活化分子浓度)决定的,而不是由活化分子数的多少决定的。
2.化学反应速率通常指在某一时间内的 ,而不是某时刻的 。在具体反应中各时刻的反应速率是不相等的。一般不用 或 来表示化学反应速率。而且无论以反应物浓度的减少还是生成物浓度的增加来表示化学反应速率,都不取负值。
1.化学反应速率(v)的含义 、
基本计算公式 、
单位 、
同一化学反应中各物质化学反应速率之间的关系 。
42.(1分)请在A、B两题中任选一题作答。答题时请在答题卡对应的位置上填涂选答的题号。
A.[选修3一国家和国际组织常识]
材料 为了争取2012年奥运会举办权,伦敦和巴黎经过四轮激烈的争夺和角逐,最终伦敦以54比50票的微弱优势击败了呼声最高的巴黎,获得本届奥运会的主办权。为了能够使伦敦获得2012年奥运会的主办权,英国女王派女儿安妮公证到“狮城”为伦敦“呐喊助威”。
(1)英法两国政体分别代表了资本主义国家政体的两种基本形式。从国家元首的职权上看,二者有什么不同?(2分)
(2)尽管英法两国政体存在诸多差异,但也有许多相同之处,请从政体和国体的关系、国家权力运行方式两个角度分析其相同点。(8分)
福建省宁德市2010年高中毕业班教学质量检查
40.(15分)请在A、B、C三题中任选一题作答。答题时请在答题卡对应的位置上填涂选答的题号。
A.[选修2--海洋地理]
读我国东南沿海某区域图和材料,回答下列问题。
材料 1海里=1.852千米
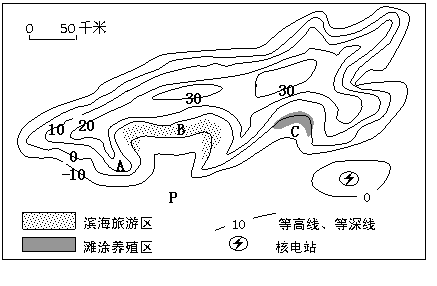
(1)判断A地的海岸类型,并按照《联合国海洋法公约》的规定,指出P点所在海域应属于我国海洋权益的何种类型并说明原因(6分)
(2)分析C海域发展滩涂养殖的不利因素和B地发展滨海旅游的有利自然条件。(9分)
B.[选修5--自然灾害与防治]
读我国蝗虫分布图,回答下列问题。
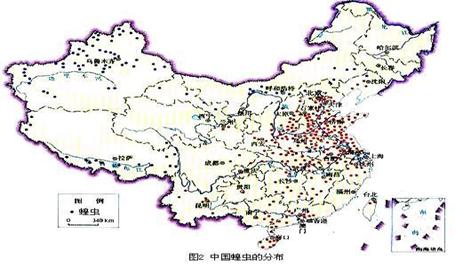
(1)蝗虫重灾区主要分布在哪个地区?本区也是严重缺水区,试分析其原因?(8分)
(2)蝗灾与旱灾经常链性发生,古代就有“旱蝗”说法,试分析其原因及蝗灾的危害?(7分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com