
4.下列叙述正确的是
A.目前加碘食盐中主要添加的KIO3
B.日常生活中无水乙醇常用于杀菌消毒
C.绿色食品是不含任何化学物质的食品
D.在空气质量日报中CO2含量属于空气污染指数
3.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
2.涂改液中含有挥发性的有毒溶剂,应告诫学生尽量不要使用,以减少对身体的毒害及对环境的污染,该溶剂所含的一种有毒成分可能是 ( )
A.乙醇 B.乙酸 C.三氯乙烯 D.甘油
1.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的 ( )
A.氧化性 B.还原性 C.酸性 D.碱性
4、HCl、NH3 等气体经喷泉实验所得溶液浓度的无数据巧算方法:令气体体积(标准状况)为1L(不论是否充满烧瓶),喷泉后溶液体积亦为1L,故C为恒值:1/22.4mol/L≈0.045mol/L;但w则不为恒值,可根据气体摩尔质量、溶液密度(视为1g/mL)求算。
例题精析
[例1]设NA为阿伏加德罗常数,下列关于 0.2mol/L的Ba(NO3)2 溶液正确的说法是( )
A 2L溶液中有阴、阳离子总数为0.8NA
B 500mL溶液中NO3_离子浓度为0.2mol/L
C 500mL溶液中Ba2+离子浓度为0.2mol/L
D 500mL溶液中含NO3― 离子总数为0.4NA
[例2]在标准状况下,1体积水溶解700体积NH3 ,所得溶液密度为0.9g/cm3,则此氨水的物质的量浓度为 ( )
A 18.4mol/L B 34.7% C 20.4mol/L D 31.2%
★虽然氨水中的主要溶质是NH3·H2O,但有关质量分数及浓度计算均以NH3计算。
[例3]将14%的KOH溶液加热蒸发掉100g水后,变成80mL28%的KOH溶液,则此时溶液的物质的量浓度为( )
A 6mol/L B 6.25mol/L C 3.5mol/L D 7mol/L
建议:近年的高考化学中计算题的失分主要是在计算,建议计算过程中一律在小数点后保留一位小数(除非题中有有效数字取舍的强调或暗示),平时少用计算器。
[例4]标准状况下,用一定量的水吸收氨气后制得浓度为12mol/L、密度为0.915g/cm3的氨水。试计算1体积水吸收多少体积的氨气可制得上述氨水(水的密度以1.00g/cm3)?
[备选例题]超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3 +N2
+3C 2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
2AlN+3CO,由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品有关成分的含量,进行了以下两个实验:
(1) 称取10.00g样品,将其加入过量的NaOH 浓溶液中共热并蒸干,AlN跟NaOH 溶液反应生成NaAlO2 ,并放出氨气3.36L(标准状况).
① 上述反应的化学方程式为______________________________________________.
② 该样品中的AlN的质量分数为____________________
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应)。该样品中杂质炭 g。
3、 溶液稀释或混合的计算:
(1)可根据稀释前后,溶液中溶质的物质的量不变的公式,c1V1=c2V2或溶质的质量不变的公式,V1·ρ1·w1= V2·ρ2·w2= V1·c1·M= V2·c2·M计算有关的量。
(2)同种溶质(或含同种离子)的溶液混合,可根据混合前后溶质(或离子)的物质的量之和不变列式计算。稀释(或混合)前的溶液与水(或另一浓度的溶液)的质量可以相加。但是,体积一般不可以相加,而应运用m(后)/ρ(后)算出。只有稀释(或相互混合)且题中未给出稀释(或混合)后溶液的密度或密度变化较小时,才可忽略稀释(或混合)后的体积变化,将二者体积直接相加。
2、 溶液中溶质的质量分数与物质的量浓度之间的换算,溶液的密度是必不可少的条件。将质量分数换算成物质的量浓度时,可运用n=V·ρ·w/M算出1000mL溶液中所含溶质的物质的量。将物质的量浓度换算成质量分数时,可从1L溶液出发,运用
w=  直接计算。
直接计算。
1、 关于物质的量浓度的计算主要包括:
(1) 溶质的质量、溶液的体积和物质的量浓度之间的计算。可运用公式:n=m/M,c=n/V或运用“倍数关系”算出1L溶液所含溶质的物质的量。
(2) 已知气体溶质的体积(标准状况下)、水的体积和溶液的密度,计算溶液的密度,计算溶液中的溶质的物质的量浓度。应先运用n=V/22.4L/mol,求出溶质的物质的量,运用V=m/ρ(液) 求出溶液的体积.
(3) 计算溶液中的离子浓度,还要根据溶质的电离方程式,算出离子的物质的量。
4、 物质的量浓度溶液的配制
(1) 计算:所需固体的质量或浓溶液的体积(小数点后保留一位小数)。
(2) 称:用天平。注意NaOH 等易潮解和腐蚀性的物质要放在小烧杯中迅速称量。
量:用量筒或滴管,注意规格。
(3) 溶解:在烧杯中进行。注意烧杯规格与所配溶液体积相近,加水量为所配溶液体积的一半。
(4) 移液:在冷却后进行,注意容量瓶规格。
(5) 洗涤:洗涤烧杯、玻璃棒2~3次,一起注入容量瓶中,并轻轻摇动容量瓶,再加水至近刻度1~2cm处。
(6) 定容:注意定容后摇匀(此时液面有可能低于刻度线,那是在瓶塞处损耗之故,无需再定容)。
巧思巧解
3、 气体相对分子质量的计算
(1) 已知标准状况下气体密度ρ,M=22.4ρ
(2) 已知气体A对气体B的相对密度d,MA=dMB
(3) 已知混合气体的平均相对分子质量为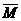 ,
,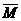 =m总/n总
=m总/n总
(式中m总是气体混合物的总质量,n总是混合气体的总物质的量)
(4)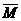 =M1w1+M2w2+……
=M1w1+M2w2+……
如M(空气)=28×78%+32×21%+40×0.94%+44×0.03%+18×0.03%=28.96
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com