
2、 某不等式的解集在数轴上表示如图所示,则这个不等式为( )
某不等式的解集在数轴上表示如图所示,则这个不等式为( )
A.x+2>0 B.x+2<0 C.x+2≥0 D.x-2≤0
1、下表给出了武汉市2009年元月份某一周中每天的最低气温,其中最低气温是( )
|
星期 |
一 |
二 |
三 |
四 |
五 |
六 |
日 |
|
最低气温 |
0℃ |
1℃ |
-1℃ |
-2℃ |
-4℃ |
-3℃ |
2℃ |
A.0℃ B.-2℃ C.-3℃ D.-4℃
20、某化学研究兴趣小组成员为探究Cu2+、Al3+在溶液中是否可以依次转化为沉淀而析出,设计了如下实验:向含有0.01molHNO3、0.001molCu(NO3)2、0.045molAl(NO3)3的溶液中逐滴加入一定浓度的NH3·H2O溶液,使混合溶液的pH值不断升高,当加至溶液的体积为45 mL时Al3+开始反应生成成沉淀,当加至溶液的体积为50 mL时Cu2+开始反应生成沉淀。(不考虑溶液的体积变化)
已知:常温下Ksp[Al(OH)3]=1.0×10-33mol·L-4,Ksp[Cu(OH)2]=2.0×10-20mol·L-3。
求:①Al(OH)3开始析出时溶液的pH值?
②若溶液中离子的浓度约为1.0×10-5 mol/L时可视为沉淀完全,则当Al(OH)3沉淀完全时Cu(OH)2是否析出?
南京师大附中2009-2010学年第一学期期末考试
19、下表为元素周期表中第四周期的部分元素(从左到右按原子序数递增排列),根据要求回答下列各小题:
|
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有 种。
(2)试比较:第一电离能I1(Cr) I1(Co)(填“>”、“<”或“=”,下同);
晶格能U(MgO) U(NaCl)。
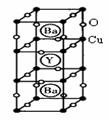 (3)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如右图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。
(3)钇钡铜氧是一种新型节能高温超导体,其晶胞结构如右图所示,研究发现,此高温超导体中的Cu元素有两种价态,分别为+2价和+3价,Y元素的化合价为+3价,Ba元素的化合价为+2价。
①该物质的化学式为: 。
②该物质中Cu2+与Cu3+的原子个数比为: 。
(4)现有含钛的两种颜色的晶体,Ti3+的配位数均为6,一种为紫色,一种为绿色,相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的2/3。
试推断紫色晶体的化学式为 。
18、10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
17、已知A、B、C、D和E 5种分子所含原子的数目依次为1、2、3、4和5,且都含有10个电子。又知B、C、D和E均是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是___________________________;
(2)B的分子式是__________;C分子属于__________分子(填“极性”或“非极性”);
(3)若向D的稀溶液中滴加少量酚酞,溶液由无色变为浅红色,则D的电子式是 ,
其原因是(用电离方程式表示)________________________。
16、实验室常用邻苯二甲酸氢钾(KHC8H4O4)来标定氢氧化钠溶液的浓度,若氢氧化钠溶液的浓度为0.1摩/升,到达滴定终点时,溶液的pH值约为9.1。
(1)为标定氢氧化钠溶液的浓度,应选用 作指示剂;
(2)在测定氢氧化钠溶液浓度时,有下列一些操作:①向溶液中加入1-2滴酚酞指示剂;②向锥形瓶中加20-30毫升蒸馏水溶解;③用氢氧化钠溶液滴定到溶液呈粉红色,半分钟不褪色;④重复以上操作;⑤准确称取0.4-0.5克邻苯二甲酸氢钾加入250毫升锥形瓶中;⑥根据两次实验数据计算氢氧化钠的物质的量的浓度。
以上各步中,正确的操作顺序是 (填序号);
(3)上述操作中,将邻苯二甲酸氢钾直接放入锥形瓶中溶解,对实验是否有影响 ;(填“是”或“否”)说明理由 ;
(4)滴定前,用蒸馏水洗净碱式滴定管,然后加待测氢氧化钠溶液滴定,此操作对实验结果的影响 (填偏大、偏小或无影响)。
15、(1)有四瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.30mol/LCH3COOH水溶液 ④40毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是___________。
(2)25℃时,有pH=x的盐酸和pH=y 的氢氧化钠溶液(x≤6,y≥8),取aL该盐酸与该氢氧化钠溶液中和,消耗bL的氢氧化钠溶液,问:
①若x+y=14,则a/b=__________(填数据);
②若x+y=13,则a/b=_________(填数据);
③若x+y>14,则a/b=___________(填表达式);
14、依据氧化还原反应:2Ag+(aq)+Cu(s) = Cu2+(aq)+2Ag(s)设计的原电池如下图所示。
|


请回答下列问题:
(1)电极X的材料是________;电解质溶液Y是___________;
(2)银电极为电池的________极, X电极上发生的电极反应为_____________;
(3)外电路中的电子是从_______电极流向________电极。(填元素符号)
13、25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
A.Na2CO3溶液中:2c(Na+) =c(CO32-)+c(HCO3-) +c(H2CO3)
B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:
c(Na+)+ c(H+)= c(OH-)+c(CH3COO-)
C.NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:
c(Na+)>c(SO42-) >c(NH4+) >c(OH-) =c(H+)
D.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:
c(CH3COONa)>c(Na2CO3) >c(C6H5ONa ) >c(NaOH )
第Ⅱ卷(非选择题 共57分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com