
7.为强化正面舆论引导,积极加入主流媒体,中央电视台在央视网基础上开通了中国网络 电视台(英文简称CNTV),其视频播放依赖于 技术。 ( )
A.流媒体 B.人工智能 C.图像处理 D.信息集成
6.中央政治局常委李长春同志,在2009年12月全国宣传部长会议和2010年1月中国网络电视台开播仪式时谈到,主流媒体正向互联网延伸,要积极占领主流媒体,坚持正面舆论导向,把互联网建设成新的文化阵地。这向我们传递的信息是 ( )
A.目前网络上负面信息多,对国家和社会构成了重大威胁
B.吹响了国家媒体向网络进军的号角,今后政府会加大在网络宣传上的力度
C.互联网中政府的声音是极为微弱的,没有起到任何作用
D.今后将限制个人在网络信息交流方面的自由
22.(12分)[化学--物质结构与性质]
A、B、C、D分别代表四种不同的短周期元素。A元素原子的最外层电子排布为
ns1,B元素原子的价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个电子。
(1)C原子的价电子排布式为 ,若A元素的原子最外层电子排布为1s1,则按原子轨道的重迭方式,A与C形成的化合物中的共价键属于 键。
(2)当n=2时,B与C形成的晶体属于 晶体;当n=3时,B与C形成的晶体中微粒间的作用力是 。
(3)若A元素原子的最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,则元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
21.(12分)[化学--有机基础]
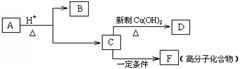 有机物A是有机合成的中间体,分子中含2个氧原子,其燃烧产物n(CO2):n(H2O)=2:1,质谱图表明A的相对分子质量为188,在一定条件下可以转变为B和C(分子式:C4H6O),相关转化关系如图所示:
有机物A是有机合成的中间体,分子中含2个氧原子,其燃烧产物n(CO2):n(H2O)=2:1,质谱图表明A的相对分子质量为188,在一定条件下可以转变为B和C(分子式:C4H6O),相关转化关系如图所示:
已知:①R-CH=CH-OH会自动转化为R-CH2-CHO;
②同一个碳原子上连有两个双键的结构不稳定;
③B苯环上的一氯取代物有两种同分异构体;C分子中无支链。
请根据以上信息,回答下列问题:
(1)A的分子式是_________________;
(2)B中含氧官能团的名称是_______________;
(3)F的结构简式是____________________;
(4)写出由C生成D的化学方程式:__________________________________________;
(5)C有多种同分异构体,其中与C具有相同官能团的同分异构体(不含C)共有____种;
(6)上述转化过程中不涉及的有机反应类型有__________(填序号)。
①取代反应 ②聚合反应 ③消去反应 ④氧化反应 ⑤还原反应 ⑥水解反应
20.(12分)2009年10月15日新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s) +1/2O2(g)=CO(g) ΔH= -126.4 kJ·mol-1
2H2(g) +O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1 H2O(g)= H2O(l) ΔH= -44 kJ·mol-1
则在25℃,101kPa时:C(s) + H2O(g)= CO(g) + H2(g) ΔH=____________________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该反应是否处于化学平衡状态____________(填“是”或“否”),其判断依据是______
____________________________________________________________。
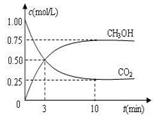 (3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)
ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②下列措施能使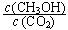 增大的是________(填符号)。
增大的是________(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
[选做部分包括21、22两个小题,考生从中选择一个作答]
19.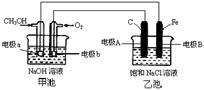 (12分)某化学过程的示意图如图所示,在装置工作过程中,甲池的总反应式为:2CH3OH+3O2+4NaOH=2Na2CO3+6H2O。试回答下列问题:
(12分)某化学过程的示意图如图所示,在装置工作过程中,甲池的总反应式为:2CH3OH+3O2+4NaOH=2Na2CO3+6H2O。试回答下列问题:
(1)甲池溶液中的Na+移向_______(填“a”或“b”)电极;乙池溶液中的Na+移向_______(填“A”或“B”)电极。
(2)电极A的名称为:______________;
(3)电极b上发生的电极反应为:________________________________。
(4)乙池中发生反应的离子方程式为___________________________________________。
(5)当乙池中电极A处得到0.71g产物时,甲池中理论上消耗O2_____________mL(标准状况下)
18.(12分)W、X、Y、Z是原子序数依次增大的四种短周期元素,已知:W的一种原子的原子核中没有中子;Y与X相邻,Y与Z也相邻;X、Y、Z三种元素原子的最外层电子数之和为3的整数倍;元素Z在地壳中含量最高。试回答下列各题:
(1)已知W、Y、Z三种元素两两组合,可组成多种10电子微粒,写出其中两种离子发生反应生成两种分子的离子方程式_______________________________________。
(2)由W、X、Z三种元素可组成A、B、C三种常见的有机化合物,其中A和B是日常生活中常用调味品的主要成分,且A与B能够反应生成C,试写出该反应的化学方程式___________________________________________________________。
(3)由W、X、Y、Z四种元素中的三种元素组成的某种化合物,其浓溶液可与其中第四种元素的单质发生反应,写出该反应的化学方程式______________________________。
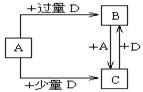 (4)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系。
(4)已知由元素X和Z可组成A、B、C、D四种中学化学常见的单质或化合物,四种物质之间存在如图所示的转化关系。
①写出A与B反应生成C的化学方程式____________________________________;
②向50 mL4 mol·L-1的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中溶质的
物质的量之比为__________________________________。
(5)W、Y、Z三种元素可组成一种无机盐,其组成可表示为W4Y2Z3,则该溶液中离
子浓度由大到小的顺序为____________________________________________。
17.(12分)化学是一门以实验为基础的自然科学,掌握实验方法以及完成化学实验所必需的技能,是学好化学的关键。试回答下列与实验有关的问题:
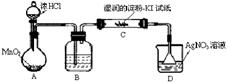 (1)某同学认为MnO2与浓HCl反应制得的Cl2中含有HCl气体,该同学设计如图所示装置进行验证。最终该同学判定含有HCl气体的依据是:装置C中的试纸颜色无变化,装置D中产生白色沉淀。(部分夹持装置和加热装置省略)
(1)某同学认为MnO2与浓HCl反应制得的Cl2中含有HCl气体,该同学设计如图所示装置进行验证。最终该同学判定含有HCl气体的依据是:装置C中的试纸颜色无变化,装置D中产生白色沉淀。(部分夹持装置和加热装置省略)
①装置B中的试剂是_______________(填写名称);
②装置C的作用是______________________________________。
(2)某课外研究小组设计如图所示的实验过程,用石油化学工业的废弃催化剂(主要成分:Ag/a-Al2O3)来回收金属银和a-Al2O3,a-Al2O3作为催化剂的载体,且不溶于硝酸。(部分操作过程省略)
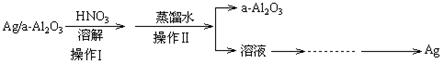
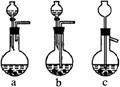 ①进行操作Ⅰ可选用右图所示装置中的装置_____(选填a、b、c);
①进行操作Ⅰ可选用右图所示装置中的装置_____(选填a、b、c);
②实验操作Ⅱ中,所需的主要玻璃仪器有______________________;
③实验操作Ⅱ中能否用自来水代替蒸馏水,_________(填“能”或“否”);为什么?_____________________________________________________________
_____________________________(请结合有关离子方程式回答)。
16.研究发现铜具有独特的杀菌功能,能较好地抑制病菌的生长。在工业上铜的冶炼大致可分为:①富集:将硫化物矿石进行浮选;②焙烧,主要反应为:2CuFeS2+4O2=Cu2S+3SO2+2FeO(炉渣);③制粗铜,在1200℃发生的主要反应为:2Cu2S+3O2=2Cu2O+2SO2;2Cu2O+Cu2S=6Cu+SO2↑;④电解精炼。
下列说法不正确的是
A.上述生产过程中的尾气可以通入氨水中,生产氮肥
B.每生产6mol Cu,理论上需消耗11mol O2
C.反应2Cu2O+Cu2S=6Cu+SO2↑中的还原剂是Cu2S
D.电解精炼时,粗铜应与外电源的正极相连
高三化学试题
第Ⅱ卷(共60分)
15.在室温条件下,向含有H2SO4的CuSO4溶液中逐滴加入含a mol溶质的NaOH溶液,
恰好使溶液的pH=7,下列叙述正确的是
A.溶液中2c(Na+)=c(SO42-) B.a/2 mol>沉淀的物质的量>0
C.沉淀的物质的量= a/2 mol D.原溶液中c(H2SO4) = a/2 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com