
下图是“我国某地地形和构造剖面图”,读图回答7-8题:
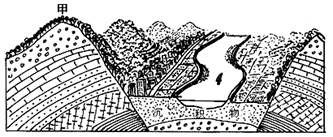
7. 有关该地河谷地形的成因,正确的说法是:
A.背斜顶部受张力,受流水侵蚀作用形成
B.向斜岩层向下弯曲,河流携带泥沙沉积形成的
C.岩层断裂下陷,河流携带泥沙沉积形成的
D.岩层断裂上升,受流水侵蚀作用形成
8.图中甲山脉如果是大兴安岭,则下列说法正确的是:
A. 该山脉的东侧是东北平原主要发展种植业
B. 该山脉的东侧河流有两个汛期是夏汛和秋汛
C.该山脉是我国的800mm等降水量线
 D.该山脉的西侧是黄土高原,水土流失比较严重
D.该山脉的西侧是黄土高原,水土流失比较严重
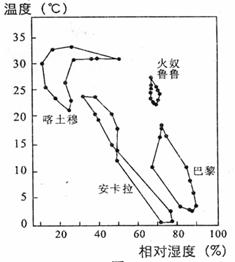 读世界四个地区的气候统计资料,回答5-6题:
读世界四个地区的气候统计资料,回答5-6题:
5.危害柑橘的地中海蜡实蝇生活的最适宜温度和湿度
范围是16℃-32℃和75%-85%,其中四个地区
最适宜蜡实蝇生活的是:
A.喀土穆 B.巴黎
C.安卡拉 D.火奴鲁鲁
6.安卡拉的气候特征与下列那种气候的特征最相似:
A.温带海洋性气候
B.温带季风气候
C.地中海气候
D.亚热带季风气候
下图是“某地地形简图”,M点位于36.5°N。两中学生分别到达P、M点.测量并计算出两点相对高度是288米。读图回答3-4题。
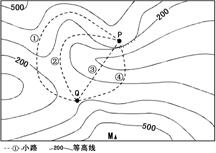
3.图中P.Q两点之间的四条小路中起伏最小的是
A.① B.② C.③ D.④
4.冬至日正午,M峰顶的影子正好移至P点,则P-M之间的水平距离大约是
A.300米 B.400米 C.500米 D.600米
下图是全球某日某时刻的昏线(线上的数据为经度)。据此回答1-2题。
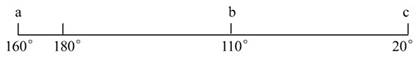
1.此时北京时间为 A. 14:40 B. 9:20 C. 21:20 D. 15:20 2.若c点为69°N,则下列说法正确的是 A. 天山牧民利用云杉林以下的牧场放牧 B. 北半球各地昼短夜长 C. 南极大陆终日斜阳 D. 黄淮海平原土壤盐分全年最低
(二)选考题:(共15分,请考生从给出的3道试题中任选一题做答。如果多做,则按所做的第一题计分。)
29.[化学一一选修化学与技术](15分)
硫酸工厂排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前必需进行尾气处理并设法进行综合利用。
(1)硫酸工厂排放尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程的化学反应方程式:
,
②请说出这种尾气处理方法的优点(说出两点即可)
③若某硫酸厂每天排放的1万米3。(标准状况)尾气中含0.2%(体积百分数)的SO2,通过上述方法处理,理论上需生石灰 kg。
(2)近闻美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,该方法:第一步是用Na2SO3水溶液吸收SO2,第二步是加热吸收溶液,可得到含高浓度SO2的水蒸气副产品。
这种尾气处理方法与(1)相比的优点是 。
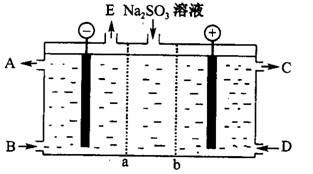 (3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO。溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如A图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO。溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如A图,a、b离子交换膜将电解槽分为三个。区域,电极材料为石墨。
①图中a表示 离子交换膜(填“阴”或“阳”)。A-E分别代表生产中的原料或产品,其中C为硫酸,则A表示 ,E表示 。
②阳极的电极反应式为 。
 30.[化学一一选修物质结构与性质](15分)
30.[化学一一选修物质结构与性质](15分)
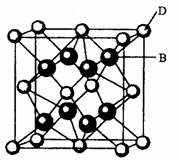
有A、B、C、D、E、F六种元素,A是周期表中原
子半径最小的元素,B是电负性最大的元素,C的2p轨
道中有三个未成对的单电子,F原子核外电子数是B与
C核外电子数之和,D是主族元素且与E同周期,E能
形成红色(或砖红色)的E2O和黑色的EO两种氧化物,
D与B可形成离子化合物其晶胞结构如右图所示。请
回答下列问题。
(1)E元素原子基态时的电子排布式为 ;
(2)A2F分子中F原子的杂化类型是 ,F的氧化物FO3分子空间构型为
;
(3)CA3极易溶于水,其原因主要是 ,试判断CA3溶于水后,形成CA3·H2O的合理结构 (填字母代号),推理依据是:
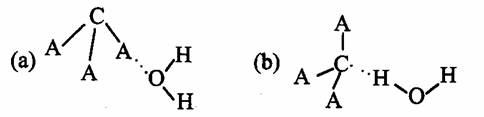 。
。
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3。,则晶胞的体积是 (写出表达式即可)。
31.[化学一一选修有机化学基础](15分)
高效低毒杀虫剂氯菊酯(I)可通过下列合成路线制备:
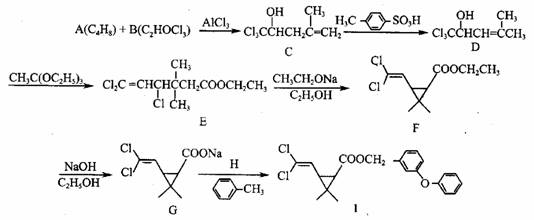
(1)化合物A能使溴的四氯化碳溶液褪色
①A的化学名称是 ,B的结构简式 ;
②化合物I中官能团的名称是 ;
③在化合物E转化成化合物F的反应中,能否用NaOH/C2H5OH代替C2H5Ona/C2 H5OH溶液? (填“能”或“不能”),其原因是
。
④化合物H的结构简式为 ,写出由G生成I的化学反应方程式
,写出由G生成I的化学反应方程式
(2)芳香化合物J比F少两个氢,J的分子核磁共振氢谱有三个峰,峰面积之比是9:2:1,则J可能的结构简式为(写出1种即可)
。
(一)必考题(本大题共5题,共44分)
24.(9分)
元素A、B、C、D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
|
元素 |
A |
B |
C |
D |
|
性质结构信息 |
单质在氯气中燃烧火焰呈黄色并产生大量白烟,所得产物的阳离子与E的阳离子电子数相同。 |
单质是带有金属光泽的灰黑色固体,是信息技术的关键材料。 |
最高价氧化物的水化物与其气态氢化物反应得到离子化合物E。 |
氧化物是一种耐火材料,能溶于A的最高价氧化物的水化物得到F。 |
(1)写出B在元素周期表的位置_______________________。
(2)E的阳离子的电子式_____________检验E中阳离子的实验方法是_______________
______________________________________________________________________。
(3)写出D单质直接转化成F的离子方程式__________________________________。
(4)E的水溶液呈_________(填“酸性”、“碱性”或“中性”),其原因用离子方程式表示为_________________________________________________________________。
25.(7分)
在一定温度下,将0.20molN2O4气体充入2.0L密闭容器中,间隔一定时间对该容器的气体进行分析数据如下:
|
时间 (s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)mol/L |
0.10 |
C1 |
0.050 |
C3 |
C4 |
|
c(NO2)mol/L |
0.00 |
0.060 |
C2 |
0.12 |
0.12 |
(1)该反应的平衡常数表达式为________________________________,计算20s到40s二氧化氮的平均反应速率v(NO2)===____________。
(2)若在相同条件下最开始充入的是NO2气体,使得达到上述同样的平衡状态,NO2的起始浓度是___________。
(3)若在相同条件下起始时充入的NO2气体0.16mol,要计算达到平衡时NO2的转化率,请写出分析求解的思路(不必计算具体结果)____________________________。
26.(7分)
某化学实验小组将适量浓硝酸分多次滴加入到足量铜粉、足量稀硫酸的混合物中,加热使之反应完全,通过过滤、蒸发、结晶来制得硫酸铜晶体(装置如图1、2所示)。
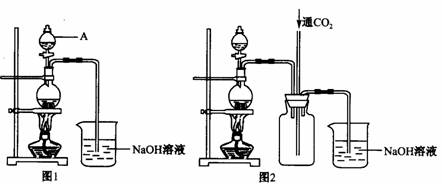
(1)写出圆底烧瓶中开始阶段发生反应的化学方程式 。
(2)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是 。
(3)图2是图1的改进装置,其优点有 。
27.(11分)
甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol,甲醚可作燃料电池的燃料。工业上用合成气(CO、H2)直接或间接制取甲醚。
(1)写出甲醚燃烧的热化学方程式 。
 (2)已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH2OCH3(g)的反应热为 。
(2)已知H2(g)和C(s)的燃烧热分别是285.8 kJ·mol-1、393.5 kJ·mol-1;计算反应4C(s)+6H2(g)+O2(g)==2CH2OCH3(g)的反应热为 。
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极
可构成燃料电池。该电池的负极反应式为
;
从能量角度分析甲醚用作燃料电池与直接燃烧相比
主要的优点是 。
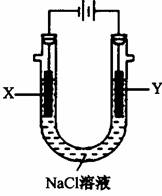
(4)用(3)中的燃料电池为电源,以石墨为电极电解
500 mL滴有酚酞的:NaCl溶液,装置如图所示:
①请写出电解过程中Y电极附近观察到的现象
。
②当燃料电池消耗2.8 LO2(标准状况下)时,计算
此时:NaCl溶液的pH= (假设溶液的体积不变,气体全部从溶液中逸出)。
28.(10分)
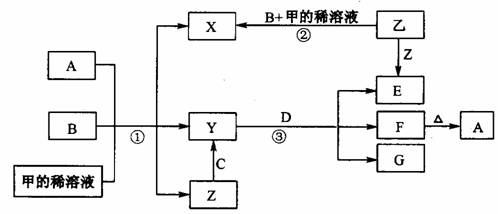 下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题:
下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题:
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为 ,C为 (填写化学式)。
A与B物质的量应满足的关系为 。
(2)写出反应③的化学方程式 。
(3)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式 ,并分析产生气体的原因 。
23.将17.9 gAl、Fe、Cu组成的合金溶于足量的:NaOH溶液中,产生气体3.36 L(标准状况)。另取等质量的合金溶于过量的稀硝酸中,生成6.72 LNO(标况),向反应后的溶液中加入过量的NaOH溶液,得到沉淀的质量为 ( )
A.33.2 g B.25.4 g C.22.4 g D.19.6 g
第Ⅱ卷(非选择题,59分)
22.下列选项中,微粒的物质的量浓度关系正确的是 ( )
A.0.1mol/L的Na2CO3溶液中:c(OH-)==c(HCO-3)+c(H+)+c(H2CO3)
B.0.1mol/LNH4Cl的溶液与0.5mol/L的NaOH溶液等体积混合后,得到的溶液中:
c(Cl-)>c(Na+)>c(NH+4)>c(OH-)>c(H+)
C.向硝酸钾溶液中滴加稀盐酸得到pH=4的混合溶液:c(K+)==c(NO-3)
D.浓度分别为0.1mol/L和0.01mol/L的CH3COOH溶液中:
CH3COO-离子浓度前者是后者的10倍
20.A、B、C、D、E五种元素具有相同的电子层数,A和B的最高价氧化物对应的水化物呈碱性,且碱性B>A;C和D的气态氢化物的水溶液呈酸性,且酸性C>D;五种元素所形成的简单离子中,E的离子半径最小,则它们的原子序数由大到小的顺序是 ( )
A.CDEAB B.:ECDAB C.BAEDC D.BADCE
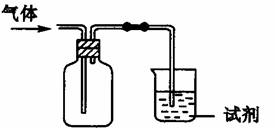 21.下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是 ( )
21.下图装置可用于收集气体X并验证其某些化学性质,你认为正确的是 ( )
|
选项 |
气体 |
试剂 |
现象 |
结论 |
|
A |
SO2 |
酸性KMnO4溶液 |
溶液褪色 |
SO2有氧化性 |
|
B |
C2H4 |
溴水 |
溶液褪色 |
能发生加成反应 |
|
C |
X |
澄清石灰水 |
溶液变浑浊 |
X不一定是CO2 |
|
D |
Cl2 |
紫色石蕊试液 |
溶液先变红后褪色 |
Cl2有酸性和漂白性 |
19.有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl混合而成,为检验它的成分做了如下实验:①将固体混合物溶于水,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀生成;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。则该固体混合物中 ( )
A.肯定有Na2SO4 可能有CuSO4 B.一定有NaCl 肯定没有Na2SO4
C.一定有Na2CO3 可能有NaCl D.可能有CaCl2 一定没有CuSO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com