
19.某阳离子Mn+ 的核外共有x个电子,核内有a个中子,则M的质量数为( )
A.a+x-n B.a+x+n C.a-x-n D.a-x+n
18.核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A. 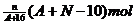 B.
B. 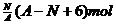
C. 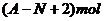 D.
D. 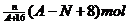
17.元素性质存在周期性变化的本质原因是( )
A.元素原子相对原子质量周期性变化的结果
B.元素原子核外电子排布周期性变化的结果
C.元素的原子序数递增的结果
D.元素金属性和非金属性周期性变化的结果
16.从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既
有旧化学键的断裂,又有新化学键的形成的变化是( )
A.Cl2溶于水 B.碘升华 C.氯化钠受热熔化 D.酒精溶解于水
15.关于离子键、共价键的各种叙述中,下列说法中正确的是( )
A.在离子化合物里,只存在离子键,没有共价键
B.非极性键只存在于双原子的单质分子(如Cl2)中
C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键
D.由不同元素组成的含多个原子的分子里,一定只存在极性键
14.关于元素周期表,下列叙述中不正确的是( )
A.在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B.在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素
C.在元素周期表的左下角可以寻找制备新型农药材料的元素
D.在地球上元素的分布和它们在元素周期表中的位置有密切关系
13.某元素原子L层电子数比K层的多5个,该元素的最高正化合价为( )
A.+5 B.+6 C.+7 D.无最高正化合价
12.镭是元素周期表中第七周期第IIA族元素,关于其叙述不正确的是( )
A.镭的金属性比钙弱 B.单质能与水反应生成H2
C.在化合物中呈+2价 D.碳酸镭难溶于水
11.下列关于物质性质变化的比较,不正确的是 ( )
A.原子半径大小: Na > S > O B.气态氢化物稳定性: HBr < HCl < HF
C.碱性强弱: KOH > NaOH > LiOH D.还原性强弱: F- > Cl- > Br- > I-
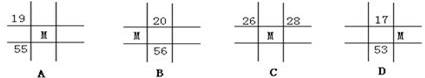
10.下列为元素周期表中的一部分,表中数字为原子序数, M的原子序数为37的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com