
20.物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4
B.1:5 C. 2:3 D.2:5
第Ⅱ卷 非选择题(60分)
19.取浓度均为0.05 mol·L-1的硫酸和NaOH溶液,以2:3体积比相混合,所得溶液的pH为
A.2 B.3 C.11 D.12
18.有五种化合物:① NaHCO3 ② (NH4)2CO3 ③ AlCl3 ④ Al(OH)3 ⑤ NaAlO2 ,其中既能与氢氧化钠溶液反应, 又能与盐酸反应的是
A. ②③⑤ B. ②④⑤ C. ③④⑤ D.①②④
17.下列操作中正确的是
A.滴定时,左手握住滴定管活塞,右手震荡锥形瓶,眼睛注视滴定管内液面变化
B.用0.1000 mol·L-1 NaOH溶液来滴定未知浓度的盐酸时,装标准液的碱式滴定管润洗2次后进行滴定
C.潮湿的或有腐蚀性药品,必须在玻璃器皿里称量,其它固体药品可直接在托盘上称量
D.把装有NaOH溶液的滴管插入FeS04溶液液面下以制备Fe(OH)2
16.下列离子方程式中,正确的是
A.向AlCl3溶液中滴加过量氨水:Al3++ 4 NH3•H2O
===AlO2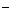 +4NH4+
+ 2H2O
+4NH4+
+ 2H2O
B.大理石和稀盐酸的反应:CO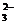 + 2 H+== CO2 ↑ + H2O
+ 2 H+== CO2 ↑ + H2O
C.碳酸氢钠溶液和氢氧化钠溶液反应:HCO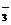 + OH-== CO
+ OH-== CO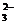 + H2O
+ H2O
D.铜和稀硝酸反应:Cu+2H++NO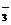 =Cu2++NO↑十H2O
=Cu2++NO↑十H2O
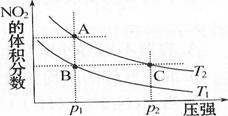
15.反应N2O4(气)  2NO2(气) 正反应吸热,在温度为,T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是
2NO2(气) 正反应吸热,在温度为,T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是
 A.
A、C两点的反应速率:A>C
A.
A、C两点的反应速率:A>C
B. A、C两点气体的颜色:A深,C浅
C. 由状态B到状态A,可以用加热的方法
D. A、C两点气体的平均相对分子质量: A>C
14.下列比较中,正确的是
A.常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大
B.某溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合,则
c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
C.物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:
c (Na+) + c(H+) = c (CH3COO-) + c (OH-) + c (CH3COOH)
D.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,
其中c(NH4+) 由大到小的顺序是:①>②>④>③
13.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如图),一定没有沉淀生成的是
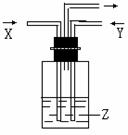
|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
CO2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
CaCl2 |
|
D |
CO2 |
SO2 |
CaCl2 |
12.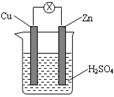 对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法正确的是
对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法正确的是
①Zn是负极 ②Cu是正极
③Zn -2e-==Zn2+ ④Cu2+ +2e-== Cu
⑤电子由铜片经导线流向锌片
A.①②③ B.①②⑤ C.②③④ D.②③⑤
11.某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,则M可能为
A.HCO3- B.Fe2+ C.I- D.Cu2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com