
1.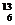 C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关
C-NMR(核磁共振)可以用于含碳化合物的结构分析,有关 C的说法正确的是
C的说法正确的是
A.质子数为6 B.电子数为13
C.中子数为6 D.质量数为6
29.(4分)向15gFe和Fe2O3混合物中,加入150mL3.5mol·L-1的稀H2SO4,在标准状况下放出1.68LH2,此时Fe和Fe2O3均无剩余,再向溶液滴入KSCN溶液未见颜色变化,为中和过量的H2SO4消耗了3mol·L-1的NaOH溶液200mL。
则Fe的质量为 g,Fe2O3的质量为 g。
云南省楚雄市2009~2010学年度上学期期末检测试题
27.(6分)某研究性学习小组对铝热反应实验展开研究,关于铝热反应的现象有:反应放出大量的热,并发出耀眼的光芒,纸漏斗的下部被烧穿,有熔化物落入沙中。查阅《化学手册》可知,Al、Fe2O3、Al2O3、Fe的熔沸点数据如下:
|
物质 |
Al |
Fe2O3 |
Al2O3 |
Fe |
|
熔点(℃) |
660 |
1462 |
2054 |
1535 |
|
沸点(℃) |
2467 |
-- |
2980 |
2750 |
(1)请写出“铝热反应”的化学方程式
某同学推测,铝热反应所得到的熔化物应是铁铝合金,理由是:该反应放出的热量能使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理? 。(填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔化物中含有金属铝。请填写下列表格:
|
所用试剂 |
溶液 |
|
实验操作及现象 |
取适量块状熔化物于试管中,加人 。 |
|
有关反应的化学方程式 |
|
26.Ⅰ(9分)已知氨可以与灼热的氧化铜反应得到氮气和金属铜,用示意图中的装置可以实现该反应。
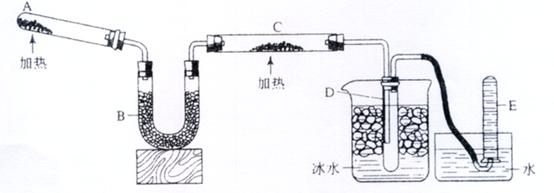
回答下列问题:
(1)A中加入的物质是________________________.
发生反应的化学方程式是______________________________________;
(2)B中加入的物质是_____________,其作用是________________________:
(3)发生反应的化学方程式是_____________________________________;
(4)实验时在D中观察到得现象是__________________________________,
E中收集到的物质是_____ _________,
Ⅱ(3分)甲、乙两个同学同时设计了一份表格,用于酸碱中和滴定实验的数据记录和处理。甲同学设计的表格和实验记录结果如下
|
次数 |
V(HCl)/mL |
V(NaOH))/mL |
|
1 |
25.00 |
22.40 |
|
2 |
25.00 |
22.30 |
乙同学设计的表格和实验记录结果如下:
|
次数 |
V(HCl)/mL |
V(NaOH)/mL |
||||
|
始读数V1 |
终读数V2 |
V2-V1 |
始读数V1′ |
终读数V2′ |
V2′-V1′ |
|
|
1 |
0.00 |
25.00 |
|
0.00 |
22.30 |
|
|
2 |
0.00 |
25.00 |
|
0.10 |
22.40 |
|
你认为甲、乙两同学设计的表格哪个比较合理 (填“甲”或“乙”)。若标准液氢氧化钠的浓度为0.1000 mol·L-1选择你认为合理表格中的实验数据,计算c(HCl)= mol·L-1。
25.(每空2分,共10分)A通常存在于钢铁中,它由丙丁两种元素分别按原子个数比2:1和3:1组成的化合物混合而成,这两种化合物的相对分子质量分别为124,180。A的含量、形状、分布对钢性能影响很大,使钢硬而脆,不宜机械加工。已知:(1)甲、乙、丙为重要的金属单质;(2)丁、戊为非金属单质,其中丁为黑色固体,戊是空气的主要成分;(3)H为白色胶状沉淀,C为红棕色粉末,D是一种耐高温材料。
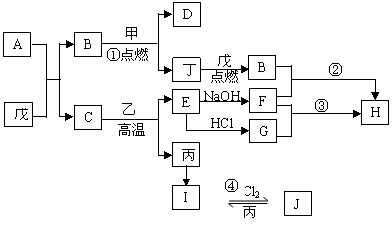
请填写以下空白:
(1)A的成分为 (用化学式表示)。
(2)写出反应①的化学方程式 。
(3)写出反应的②离子方程式 。
(4)写出反应③的离子方程式 。
(5)写出反应④的化学方程式 。
24.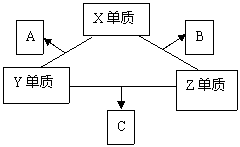 (7分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当的条件下可发生如下变化:
(7分)X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当的条件下可发生如下变化:
一个B分子中含有的Z原子个数比C分子中少一个,B、C两种分子中的电子数均等于10.请回答下列问题:
(1)X元素在周期表中的位置是第 周期 族。
(2)①C的电子式是 ,C分子的结构呈 形。
②C在一定条件下反应生成A的化学方程式是
③X、Y、Z三种元素可组成一种强酸W,C在适当的条件下被W吸收生成一种盐,该盐的水溶液PH
7(填“<”或“>”或“=”)其原因是(写离子方程式)
0.10mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞试剂、pH试纸、蒸馏水。
①甲用pH试纸测出0.10mol·L-1氨水pH为10,则认定一水合氨是弱电解质,你认为这一方法是否正确? (填是或否),并说明理由(用电离方程式表示): 。
②乙取出10mL 0.10mol·L-1氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,颜色变(填“深”或“浅”) ,你认为这一方法能否证明一水合氨是弱电解质?(填能或否) 。
③丙取出10mL0.10mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1000 mL,再用pH试纸测出其pH为b,若要确认一水合氨是弱电解质,则a、b值应满足什么关系? (用等式或不等式表示)
④请你根据所提供的试剂,再提出一个合理并简便的方案证明一水合氨是弱电解质:
。
23.(本题共11分)请根据题目要求回答下列问题。
(1)(5分)室温下有下列三种溶液 ①pH=3的盐酸 ②pH=3的醋酸 ③pH=3的硫酸
三种酸物质的量浓度由大到小的排列顺序是 (填序号);
若分别加水均稀释10倍,则pH由大到小的顺序是 (填序号);
若将③与PH=11的氨水按一定体积混合后所得溶液的pH=7,此时溶液中一定存在
c(SO42-)= c(NH4+)。(填数字)
(2)(6分)为了证明一水合氨是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验:
22.(4分)按要求完成下列各题
(1) 近年来,我国储氢纳米碳管研究获重大进展,电弧法合成的碳纳米管,常伴有大量物质--碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应的化学方程式为:
C + K2Cr2O7 + H2SO4(稀)= CO2 + K2SO4 + Cr2(SO4)3 +
① 完成并配平上述反应的化学方程式。
C + K2Cr2O7 + H2SO4(稀)= CO2 + K2SO4 + Cr2(SO4)3 +
② 反应中如有0.3 mol CO2的生成,则转移的电子数为 个。
21.(6分)(1)在一容积为10L的容器中,通入一定量的CO和H2O(气)在850℃时发生如下反应:
CO(气)+H2O(气)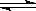 CO2(气)+H2(气)(正反应为放热反应)
CO2(气)+H2(气)(正反应为放热反应)
CO和H2O(气)浓度变化如下图一所示,则0~4min的平均速率v(CO)= mol/(L·min)
能说明该反应达到化学平衡状态的是 (填字母)。
A.υ正(CO2)=υ正(H2) B.υ逆(CO)=υ逆(H2O)
C.υ逆(H2)=υ逆(H2O) D.υ正(H2)=υ逆(H2)
|
时间(min) |
CO |
H2O |
CO2 |
H2 |
|
0 |
0.200 |
0.300 |
0 |
0 |
|
2 |
0.138 |
0.238 |
0.062 |
0.062 |
|
3 |
c1 |
c2 |
c3 |
c3 |
|
4 |
c1 |
c2 |
c3 |
c3 |
|
5 |
0.116 |
0.216 |
0.084 |
|
|
6 |
0.096 |
0.266 |
0.104 |
|
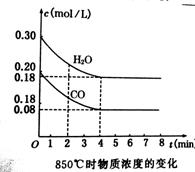
表-1
(图一)
(2)t1℃(高于850℃)时,在相同的容器中发生上述反应,容器内各物质的浓度变化如上表-1。
①表中3min~4min之间应处于 状态;c1数值 0.08mol/L(填“大于”“小于”或“等于”)
②反应在4min~5min间,平衡向逆反应方向移动,可能的原因是 (单选),
表中5min~6min之间数值发生变化,可能的原因是 (单选)
a.增加水蒸气 b. 降低温度 c. 使用催化剂 d. 增加氢气浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com