
12、 50mL物质量浓度为18mol/L的硫酸中加入足量铜片并加热,充分反应。下列有关说法中正确的是( )
A、有0.09mol的硫酸被还原  B、有0.045mol的硫酸被还原
B、有0.045mol的硫酸被还原
C、充分反应后体系无硫酸剩余  D、消耗的铜的质量一定少于2.88g
D、消耗的铜的质量一定少于2.88g 
11、用一充满氨气的烧瓶做喷泉实验,当水充满整个烧瓶后,烧瓶内的氨水的物质的量浓度是(按
0℃,101kPa计算)
A、0.045 mol/LB、1 mol/L C、0.029 mol/LD、不能确定
10、向10g不纯净的碳酸钙(杂质可能是①SiO2 ②MgCO3 ③Na2CO3 ④KHCO3中的一种)中,加入过量的
稀盐酸,充分反应并将所产生的CO2全部收集,体积为2.22L(标准状况),则这种杂质可能是( )
A、② B、④ C、①或③ D、①或④
9、有某种浓度的盐酸,将一定量的该盐酸分成三等份A、B、C。往A中加入适量蒸馏水稀释,往B中
滴加少许AgNO3溶液,过滤后保留原溶液,C保持原样,现以相同浓度的NaOH溶液中和以上三种溶液
至中性,消耗NaOH溶液的体积分别为VA、VB、VC,则它们的大小关系正确的是( )
A、VA=VC>VB B、VA<VB<VC C、VA>VC>VB D、VA=VB=VC
8、某混合溶液中含有0.2 mol Na+、0.25 mol Mg2+、0.4 mol Cl-,另一种离子为SO42-,则SO42-为(
A、0.1 mol B、0.3 mol C、0.5 mol D、0.15 mol
5、将质量分数分别为5X%和X%的硫酸等体积混合后,其质量分数为( ) A、大于3X% B、等于3X% C、小于3X% D、无法确定 6、由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( ) A、29:8:13 B、21:1:14 C、13:8:29 D、26:16:17 7、120℃时,将0.2gH2和2.8gCO的混合气体与足量O2充分燃烧后,立即将所得混合气体通过足量Na2O2粉末,固体质量将增加( ) A、2.8g B、3.0g C、7.2g D、无法确定
2、密度为1.45g·cm-3的硫酸溶液中,逐滴加入BaCl2溶液,直至沉淀完全为止,已知沉淀物的质量与原硫酸溶液的质量相等,则原硫酸溶液的浓度为( ) A、29. 6% B、42.1% C、14.8mol/L D、6.22mol/L 3、t℃时,将某硝酸钾溶液,第一次蒸发掉10g水,冷却到原温度无晶体析出;第二次蒸发掉10g水,冷却到原温度析出晶体3g,第三次蒸发掉10g水,冷却到原温度时析出晶体质量应为( ) A、等于3g B、大于或等于3g C、小于或等于3g D、无法确定 4、密度为0.91g/cm3的氨水,质量百分比浓度为25%(即质量分数为25%),该氨水用等体积的水稀释后,所得溶液的质量百分比浓度( ) A、等于12.5% B、大于12.5% C、小于12.5% D、无法确定
1、某氧化物的相对分子质量为a,其相同价态的硫酸盐的相对分子质量为b,则该元素的化合价的数值为:
A、(b-a)/20 B、(b-a)/40 C、(b-a)/80 D、(a-b)/20
0.03 0.06 0.04 X
X=3×0.06/8=0.0225mol 因此,铜离子浓度为0.225mol/L
考点2: 反应热计算及盖斯定律
例题4、肼(N2H4)是火箭发动机的燃料,反应时N2O4为氧化剂,生成氮气和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol
下列表示肼跟N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7kJ/mol
B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3kJ/mol
C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7kJ/mol
D.N2H4(g)+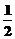 N2O4(g)=
N2O4(g)=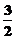 N2(g)+2H2O(g);△H=-1076.7kJ/mol
N2(g)+2H2O(g);△H=-1076.7kJ/mol
[错误分析]对盖斯定律的概念理解不透。
[答案]本题的正确选项为C
[正确解答]N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534.0kJ/mol②
②×2-①即得到
2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7kJ/mol
考点3: 电解计算
例题5、用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu(OH)2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A、0.1mol
B、0.2mol C、0.3mol
D、0.4mol
C、0.3mol
D、0.4mol

考点3:pH计算
例题6、将pH=8和pH=10的两种氢氧化钠溶液等体积混合,混合后溶液中的c(H+)最接近于( )mol/L
A.(10-8+10-10)/2 B.(10-8+10-10) C.(10-14 -5×10-5) D、2×10-10
[错误解答]因为pH=8和pH=10的两种氢氧化钠溶液的c(H+)分别为10-8 、 10-10 mol/L,而且两种溶液等体积混合,因此混合后溶液的c(H+)=(10-8+10-10)/2 mol/L。
[错解原因]直接应用溶液中c(H+)来求解,忽略溶液中c(OH-)> c(H+)和 c(OH-)对水电离平衡的影响。
[正确解答]由于碱溶液中的c(OH -)> c(H+) ,这就决定了不能用混合前溶液中的c(H+)直接求混合后溶液的c(H+) ,一定要先求出混合后溶液中c(OH-) ,在换算成混合后的c(H+) 。根据水离子积常数知,pH=8和pH=10的两种氢氧化钠溶液的c(OH-)分别为10-6和10-4 mol/L,因此混合后溶液的c(OH-) =(10-6+10-4)/2 mol/L,可近似看作为10-4/2 mol/L。根据水的离子积常数可知,混合后溶液的c(H+)=2×10-10 mol/L故正确答案选( D )2×10-10 。
考点4:原子守恒
例题7、为了测定某铜银合金成分,将30g合金完全溶于80ml13.5mol/L的浓硝酸中,待反应完全后,收集到6.72L气体(标况),并测得溶液中H+浓度是1mol/L.假设反应后溶液体积仍为80ml,求合金中银的质量分数.
[错误解答]假设银的质量分数为x,则: Ag + 2HNO3 = AgNO3 + NO2 + H2O 30x /108 60x/108 30x/108 Cu + 4HNO3 = Cu(NO3)2 +2NO2 +2H2O 30(1-x)/64 120(1-x)/64 60(1-x)/64 根据气体体积关系有: 30x/108 + 60(1-x)/64=0.3,解得x 或根据HNO3量的关系有:60x/108 +120(1-x)/64=0.08(13.5-1),解得x [错解原因]没有考虑到硝酸浓度的变化。
[正确解答]假设铜、银的物质的量依次为X、Y,则有64X+108Y=30(固体质量关系) 另有2X+Y+0.3=0.08(13.5-1)(硝酸中N的守恒),从而得到X=0.1mol,即银的质量为23.6g质量分数为78.7%
考点5:有机计算
例题8、某有机物组成中含碳54.5%, 含氢9.1%,其余为氧,又知其蒸汽在标准状况下的密度为3.94 g/L,试求其分子式。
[错题分析]没有把握好确定分子式的方法。合理采用哪种方法来解决。确定分子式方法较多,但不同的题目使用的方法不同,本题易用最简式法
根据有机物各元素的质量分数求出分子组成中各元素的原子个数之比(最简式),分子式为最简式的整数倍,因此利用物质的相对分子质量及求得的最简式可确定其分子式。
[解题指导]有机物最简式的求法为:
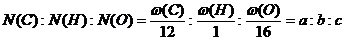 (最简整数比),最简式为CaHbOc,则分子为(CaHbOc)n,得
(最简整数比),最简式为CaHbOc,则分子为(CaHbOc)n,得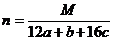 (M为有机物的相对分子质量)。
(M为有机物的相对分子质量)。
[答案]此有机物的摩尔质量为:M=ρ×Vm=3.94 g/L×22.4 L/mol=88 g/mol。
C、H、O的个数比为:
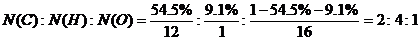
∴此烃的最简式为C2H4O,分子式为(C2H4O)n。
则有:(12×2+1×4+16)×n=88,解得:n=2
即此烃的分子式为C2H8O2。
考点6:综合计算与数据处理
例题9、在标准状况下进行甲、乙、丙三组实验:各取30mL同浓度的盐酸溶液,加入不同质量的同一种镁铝合金粉末,产生气体,有关数据记录如下:

试回答:
(1)甲组实验中盐酸______,乙组实验中盐酸______(均填“过量”、“适量”或“不足量”)。
(2)要推导出盐酸的物质的量浓度,所提供的数据中作计算依据的是______,计算出盐酸的物质的量浓度为______mol/L。
(3)要求出合金中镁、铝的物质的量之比,可作计算依据的数据是______,镁、铝的物质的量之比为______。
(4)在丙组实验之后,向容器中加入一定体积1mol/L的苛性钠溶液,可恰好使铝元素全部以偏铝酸根形式存在,并使镁离子刚好沉淀完全,则溶液中偏铝酸钠的物质的量为______mol,氯化钠的物质的量为______mol,所加苛性钠溶液的体积为______mol。
解析:本题源于基本的化学计算,通过镁铝与盐酸的反应,考查利用化学反应方程式的计算,尤其是过量计算的判断,利用多组数据的相互联系,寻找解题的突破口。注重考查应用各方面知识,进行分析、推理和判断的能力。
(1)分析甲、乙、丙三组实验的数据记录:加入合金的质量:m(甲)<m(乙)<m(丙),生成气体的体积:V(甲)<V(乙)=V(丙),由于盐酸的体积相同、浓度相同,因此,丙组实验中盐酸不足,甲组实验中盐酸过量。比较甲、乙两组数据:
m(甲)∶m(乙)=1∶1.5
V(甲)∶V(乙)=1∶1.2
则 乙组实验中盐酸是不足的。
(2)要推导盐酸的物质的量浓度,应知道盐酸的体积和HCl的物质的量。现已知盐酸的体积,HCl的物质的量可以通过乙或丙组实验产生H2的物质的量进行计算。
则:所提供的数据为:30 mL(盐酸的体积)和336mL(H2的体积)。cmol/L×0.03L=(0.336L÷22.4L/mol)×2c=1mol/L
(3)甲组实验中,镁、铝合金完全参加反应,依据合金的质量(0.255 g)和产生H2</PGN0317.TXT/PGN>(280mL)的体积,可以计算合金中镁、铝的物质的量。
设:合金中镁、铝的物质的量分别为x、y。
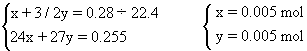
则:镁、铝的物质的量之比为1∶1。
(4)在丙实验之后,向容器中加入一定体积的苛性钠溶液,恰好使铝元素全部以偏铝酸根形式存在,使镁离子刚好沉淀完全,此时溶液中的溶质为NaAlO2和NaCl。
则n(NaAlO2)=n(Al)=0.459 g÷(24+27)g/mol=0.009 mol(54g镁铝合金中又27g铝)
n(NaCl)=n(HCl)=1mol/L×0.03 L=0.03 mol
n(NaOH)=n(NaAlO2)+n(NaCl)=0.009 mol+0.03 mol=0.039 mol
V(NaOH)=0.039 mol÷1mol/L=0.039 L 即V(NaOH)=39 mL。
0.04mol,因此,参与反应的Cu的物质的量为0.015mol,因此答案为A。解题时忽略溶液中仍然存在H+,在该条件下,生成的Cu(NO3)2中的硝酸根离子要和铜继续反应。
[正确解答]
根据3Cu + 8H+ + 2NO3- ==3Cu2+ +2NO +4H2O
3 8 2 3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com