
28.(12分)[物理--选修3-3](本题共有两小题,每小题6分,共12分。每小题只有一个选项符合题意。)
(1)下列说法中正确的是 ( )
A.扩散运动就是布朗运动
B.根据热力学第一定律可知热机效率不可能百分之百
C.空气相对湿度越大时,空气中水蒸气压强越接近饱和气压,水蒸发越慢。
 D.由于液体表面层分子间距离小于液体内部分子间距离,液体表面存在张力
D.由于液体表面层分子间距离小于液体内部分子间距离,液体表面存在张力
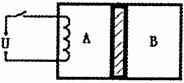
(2)如图所示,水平放置的气缸被活塞分为体积相同的
A、B两部分,活塞可以无摩擦自由移动且不漏气,气
缸和活塞均用绝热材料制成。A、B中分别装有等质量
的同种理想气体,初始时A、B的温度相同。现接通电
源,对A缓慢加热一段时间后,断开电源,活塞移动到新的位置后处于平衡状态。加热后分别用Pa、Va、Ta、Pb、Vb、Tb表示两部分气体的状态参量,Xa、Xb表示气体分子单位时间对活塞碰撞的次数,则下列说法正确的是 ( )
A.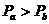 B.
B.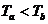 C.
C.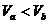 D.
D.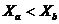
27.(16分)
淀粉的含量、直链淀粉和支链淀粉的比例及支链淀粉的精细结构等决定着水稻的产量和稻米的品质,因此水稻淀粉合成代谢的遗传研究备受关注。相关研究的部分信息如下图所示。请回答:
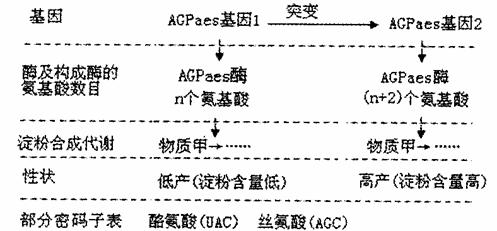
(1)AGPaes基因1通过 ① 来控制代谢过程,进而使水稻表现低产(淀粉含量低)性状。
(2)用 射线处理水稻进行诱变育种。从图中可以看出,由于水稻AGPaes基因1中发生了碱基对的 ② ,因而突变为AGPaes基因2。比较研究后发现,基因突变部位编码的氨基酸分别为酪氨酸和丝氨酸。请写出基因中编码这两个氨基酸的碱基序列,并标出转录的模板链: ③ 。
射线处理水稻进行诱变育种。从图中可以看出,由于水稻AGPaes基因1中发生了碱基对的 ② ,因而突变为AGPaes基因2。比较研究后发现,基因突变部位编码的氨基酸分别为酪氨酸和丝氨酸。请写出基因中编码这两个氨基酸的碱基序列,并标出转录的模板链: ③ 。
(3)研究表明,普通野生稻中拥有许多决定稻米优良品质的相关基因。
1)育,种工作者利用普通野生稻中存在的低比例直链淀粉突变体,以杂交育种方法培育出了优质栽培水稻品种。在杂交育种过程中,从F2代起,一般要进行多代自交和选择,自交的目的是 ④ ,选择的目的是 ⑤ 。
2)普通野生稻含有3.75×10-4对基因,假定每个基因的突变率都是10,那么在约有107个个体的种群中,每一代出现的基因突变数是 ⑥ ,它们是改良栽培稻的资源,也是生物进化的原材料。我国的普通野生稻分布于南方8个省(区),每一个分布点的普通野生稻种群都是生物进化的 ⑦ 。
3)据调查,在近30年间,我国的一千多个普通野生稻分布点已消失了80%,从生物多样性角度看,其直接后果是普通野生稻的 ⑧ 减少。普通野生稻的濒危现状与后果已引起政府和民众的高度警觉,为此我国已将普通野生稻定为一级农业野生保护植物。
选考部分
第Ⅱ卷选考部分共5题。共35分。其中,第28、29题为物理题,第30、31为化学题.考生从两道物理题、两道化学题中各任选一题作答。若第28、29题都作答.则按第28题计分。若第30、31题都作答,则按第30题计分;第32题为生物题,是必答题。请将答案都填写在答题卡选答区域的指定位置上。
26.I(12分)
某研究小组观察到紫叶李的叶片呈现紫红色,并对此现象的原因进行探究。请回答:
提出问题:
紫叶李的叶片呈现紫红色的原因是什么?
作出假设
假设1:紫叶李的叶片呈现紫红色,是因为叶片中不仅含有光合色素,还含有水溶性的花青素。
假设2:紫叶李的叶片呈现紫红色,是因为叶片 ① 。
材料和试剂
紫叶李,菠菜;丙酮,石油醚,蒸馏水,碳酸钙,二氧化硅等。
实验原理
叶片中的色素能溶解在丙酮中。石油醚与水的混合液会出现分层现象。叶绿体中的色素能溶解在石油醚中,呈现绿色;花青素能溶解在水中,呈现红色。
实验步骤
第一步:提取色素
取5g紫叶李的叶片,剪碎后放入研钵中;加入 ② ,其作用是 ③ ;再加入10mL丙酮,充分研磨后收集滤液于试管中。采用同样的方法获得菠菜叶片的色素滤液,并收集于另一支试管中。
第二步:制备双相溶剂系统
取2支试管编号为A、B,各加入2mL蒸馏水,再分别加入2mL石油醚,形成双相溶剂系统。
第三步:
从第一步的两支试管中各取2mL色素滤液,分别加入试管A、B中,振荡、混匀。
第四步:
静置一段时间后,观察试管中液体的分层情况及上下两层的颜色。
实验结果
|
组别 分层 |
紫叶李 |
菠菜 |
|
石油醚层 |
绿色 |
绿色 |
|
蒸馏水层 |
红色 |
无色 |
实验结论
④ 。
Ⅱ(12分)
下图是炎热条件下体温调节的部分过程示意图,请据图回答相关问题
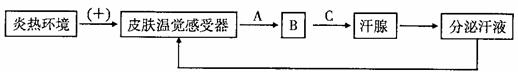 (1)图示中汗液分泌的反射途径是 ① ,其中B所在器官的名称是 ② 。
(1)图示中汗液分泌的反射途径是 ① ,其中B所在器官的名称是 ② 。
(2)当皮肤温觉感受器受到刺激产生兴奋时,膜内外两侧的电位呈 ③ 。温觉感受器产生的兴奋在反射弧中进行单向传递,是由 ④ 这一结构决定的。
(3)如图所示,分泌汗液的结果反过来又作为信息调节汗液的分泌,这种调节方式叫做
⑤ 。这是生命系统中非常普遍的调节机制,它对于机体 ⑥ 具有重要意义。
25.(15分)
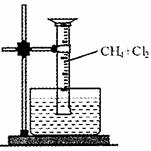 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
[实验一]用如图所示装置,收集一试管甲烷和氯气的
混合气体,光照后观察到量筒内形成一段水柱,认为有
氯化氢生成。
(1)该反应的反应类型为 ;
(2)该反应的化学方程式为 ;(只写第一步)
(3)水槽中盛放的液体应为 ;(填标号)
A.水 B.饱和石灰水
C.饱和食盐水 D.饱和NaHCO,溶液
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(4)该实验设计的错误之处 ;
[实验三]
步骤一:收集半试管氯气,加入10 mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH=3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在g0W的日光灯下光照6 min
后,加入10 mL蒸馏水,充分振荡,测得pH=1.00。
(5)判断该反应中有氯化氢生成的依据是 。
(6)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00mL,分别取20.00 mL稀释液,以K2CrO。为指示剂,用浓度为0.01 mol·L-1的AgNO3溶液滴定溶液中的C1,滴定终点时消耗AgNO,溶液的体积平均为10.00 mL,则试管中原有氯气在标准状况下的体积为 mL;
步骤三:用5支试管充满甲烷和氯气的混合气体(各占50%),分别放在40W的日光灯下光照不同时间后,加人10 mL蒸馏水,充分振荡,测得pH如下表:
|
编号 |
1 |
2 |
3 |
4 |
5 |
|
光照时间 |
2min |
4min |
6min |
8min |
10min |
|
反应后pH |
1.86 |
1.62 |
1.00 |
1.00 |
1.00 |
(7)该实验可得到结论: ;
步骤四:探究不同光照条件对甲烷与氯气反应速率的影响。
(8)试设计一个可行的实验方案: 。
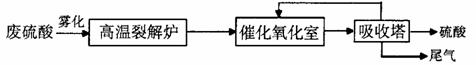
24.(15分)高温裂解法处理工业废硫酸的流程图如下:
废硫酸高温裂解的基本原理可用下列方程按两个阶段进行
H2SO4(1)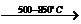 SO3(g)+H2O(g)△H=+176kJ·mol-1
SO3(g)+H2O(g)△H=+176kJ·mol-1
 2SO3(g)
2SO2(g)+O2(g) △H=+196k·mol-1
2SO3(g)
2SO2(g)+O2(g) △H=+196k·mol-1
为研究废硫酸的雾化和裂解情况,有关实验数据如下
|
|
雾化后废硫酸液滴直径 |
废硫酸完全裂解所需时间 |
|
普通雾化器 |
800-1200/μm |
10 s以上 |
|
旋转式雾化器 |
600-850 μm |
8-10 s |
|
压缩风雾化器 |
400-650 μm |
6-7 s |
|
超声波雾化器 |
100-300μm |
3.5-5 s |
(1)由上表数据可得出的结论是 ;
(2)废硫酸裂解成SO2总反应的热化学方程式为 ;
(3)在催化氧化室中发生反应:
 2SO2(g)+O2(g)
2SO3(g)△H=-196 kJ·mol-1
2SO2(g)+O2(g)
2SO3(g)△H=-196 kJ·mol-1
①某温度时,该反应的平衡常数K=3.5,平衡后再充人一定量气体测得。100 L的恒容密闭容器中含有3.0molSO2,16.0 mol O2和3.0 mol SO3(g),此时平衡 移动;(填“向正反应方向”、“向逆反应方向”或“不”)
②上述反应达到平衡后,改变下列条件,能使SO:平衡浓度比原来减小的是 ;(填字母)
A.保持温度和容器体积不变,充人1.0molO2
B.保持温度和容器内压强不变,充人3.0molN2
 C.降低温度
C.降低温度
D.在其他条件不变时,缩小容器的容积
(4)尾气SO2用饱和Na2SO3溶液吸收可得到
一种化工原料,反应的化学方程式为
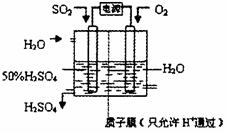
(5)科学家研究出以右图所示装置用电化学原
理生产硫酸的新工艺,其阳极的电极反应
式为 ,总反应的化学方程式
为 。
23.(15分)
甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:
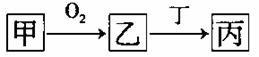
(1)若乙是目前世界倡导需减少排放的温室
气体,丁也含有A元素。则含有7个中
子的核素A可用符号表示为 ,丙溶液呈碱性的原因用离子方程式表示为 ;
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造 写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式 ;
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件下与氧气反应生成乙。若丁是稀硝酸,则乙一丙的化学方程式为 ;
(4)若A元素是第三周期元素,其最高正化合价与负价的绝对值差为4,则乙的化学式为 ,当丁是Ca(OH)2时,往丙中加人碳酸钠溶液,当碳酸钠溶液浓度大于 mol·L1时,丙可转化为碳酸钙。(已知此温度下,丙物质Ksp=1×10-6,CaCO3的Ksp=1×10-8)
21.(19分)
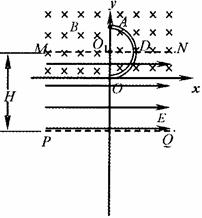
如图所示,在y≥0的区域内存在垂直于坐标平面向里的匀强磁场,磁感应强度大小为B;水平虚线MN、PQ区域内有水平向右电场强度的大小的匀强电场。半径为R的光滑绝缘空心半圆细管AD0固定在竖直平面内,圆心O,在MN上,直径AO垂直于MN。一质量为m、电荷量为q的带正电小球(可视为质点)从半圆管的A点由静止滑人管内,重力加速度为g。求:
(1)小球从A到0点的过程中,电场力对带正电小球所做的功。
(2)小球到达0点时,对半圆管的作用力大小。
(3)若小球从D点射出后,能穿过电场区域再次经过y轴,则电场区域的高度H应大于多少。
 22.(20分)
22.(20分)
磁悬浮铁路系统是一种新型的交通运输系统,它是利
用电磁系统产生的吸引力或排斥力将车辆托起,使整个列
车悬浮在导轨上。同时利用电磁力进行驱动。采用直线电
机模式获得驱动力的列车可简化为如下情景:固定在列车
下端的矩形金属框随车平移;轨道区域内存在垂直于金属
框平面的磁场,磁感应强度沿Ox方向按正弦规律分布,
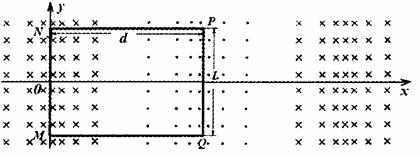
最大值为B0,其空间变化周期为2d,整个磁场以速度v1沿ox方向向前高速平移,由于列车沿Ox方向匀速行驶速度v2与磁场平移速度不同,而且v1>v2,列车相对磁场以v1- v2的速度向后移动切割磁感线,金属框中会产生感应电流,该电流受到的向前安培力即为列车向前行驶的驱动力。设金属框电阻为R,长PQ=L,宽NP=d,求:
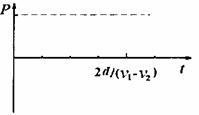 (1)如图为列车匀速行驶时的某一时刻,MN、
(1)如图为列车匀速行驶时的某一时刻,MN、
PQ均处于磁感应强度最大值处,此时金
属框内感应电流的大小和方向。
(2)列车匀速行驶s距离的过程中,矩形金属
线框产生的焦耳热。
(3)列车匀速行驶时所获得的最大驱动力的大
小,并定性四出驱动力功率随时间变化在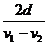 时间内的关系图线。
时间内的关系图线。
20.(15分)
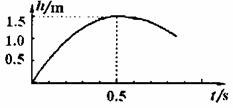
研究性学习小组在探究某球竖直向上运动过程中,通过位移传感器测得该球运动的高度与时间关系(从抛出时开始计时)如图所示。设运动过程所受的空气阻力大小保持不变,为简化计算g取l0m/s。,求:
(1)小球抛出的初速度。
(2)小球下落的加速度。
(3)从最高处落回到抛出点的时间。
19.(18分)
为了探究能量转化和守恒规律,某学习研究小组设计如图1所示装置进行实验。
(1)为了测定整个过程电路产生的焦耳热,需要知道螺线管线圈的电阻。用替代法测线圈电阻Rx的阻值可用如图2所示电路,图中R5为电阻箱(R5的最大阻值大于待测电阻尺Rx的阻值),S2为单刀双掷开关,R0为滑动变阻器。为了电路安全,测量前应将滑动变阻器的滑片P调至 ,电阻箱R5阻值应调至 (选填“最大”或“最小”)。闭合S1开始实验,接下来有如下一些操作,合理的次序是 (选填字母代号):
A.慢慢移动滑片P使电流表指针变化至某一适当位置
B.将S2闭合在1端
C.将S2闭合在2端
D.记下电阻箱上电阻读数
E.调节电阻箱R5的值,使电流表指针指在与上一次指针位置相同
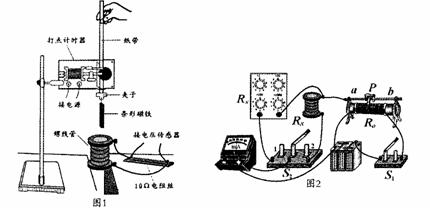
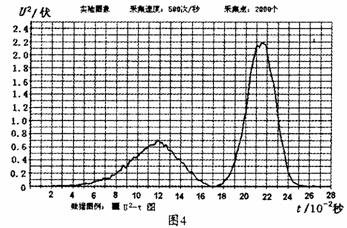
(2)按图l所示装置安装实验器材后,将质量为0.50kg蝇的条形磁铁拖一条纸带由静止释放,利用打点计时器打出如图3所示的纸带。磁铁下落过程中穿过空心的螺线管,螺线管与10Ω的电阻丝接成闭合电路,用电压传感器采集数据得到电阻两端电压与时间的U – t 图,并转换为U 2– t,如图4所示。
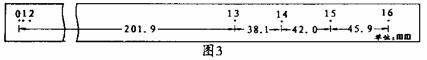
①经分析纸带在打第14点时,条形磁铁已经离线圈较远了,打第14点时磁铁速度为 米/秒。0-14点过程中,磁铁的机械能损失为 焦耳。
②若螺线管线圈的电阻是90fl,又从图4中扩一‘图线与时间轴所围的面积约为103格,可以计算磁铁穿过螺线管过程中,在回路中产生的总电热是 焦耳。
③实验结果机械能损失与回路中电流产生的热量相差较大,试分析其原因可能有
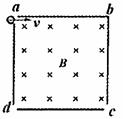
16.如图所示,将截面为正方形的真空腔abcd放置在一匀强磁场中,磁场方 向垂直纸面向里.若有一束具有不同速率的电子由小孔a沿ab方向射入磁场,打在腔壁上的被吸收,则关于由小孔c和小孔 d射出的电子的时间比值和运动速率比值正确的是 ( )
 A.
A.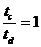 B.
B.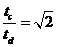
C.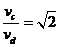 D.
D.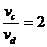
 17.如图所示,A、B两点各放有电量为+Q和+2Q的点电荷,
17.如图所示,A、B两点各放有电量为+Q和+2Q的点电荷,
A、B、C、D四点在同一直线上,且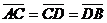 。
。
将一正电荷从c点沿直线移到D点,则 ( )
A.电势能始终增加 B.电势能始终减少
C.电场力先做正功再做负功 D.电场力先做负功再做正功
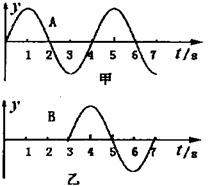 18.在置轴上有A、B两质点,其坐标分别是
18.在置轴上有A、B两质点,其坐标分别是
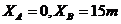 ,有一简谐波沿X正
,有一简谐波沿X正
方向传播,若以波传到A点开始计时,A,
B的振动分别如图甲、乙所示。则10秒末,
有关质点振动情况以下说法正确的是( )
A.质点B经过平衡位置
B.质点A速度方向为正方向
C.X=55m的质点在负最大位移处
D.X=30m的质点经平衡位置向上运动
第Ⅱ卷
必考部分
第Ⅱ卷必考部分共9题.157分。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com