
4.下列关于运载体的叙述中,错误的是 ( ) A.与目的基因结合后,实质上就是一个重组DNA分子 B.对某种限制酶而言,最好只有一个切点,但还要有其他多种限制酶的切点 C.目前最常用的有质粒、噬菌体和动植物病毒 D.具有某些标记基因,便于对其进行切割
3.DNA连接酶的主要功能是 ( ) A.DNA复制时母链与子链之间形成的氢键 B.粘性末端碱基之间形成的氢键 C.将两条DNA末端之间的缝隙连接起来 D.将碱基、脱氧核糖、磷酸之间的键连接起来
2.下列四条DNA分子,彼此间具有粘性末端的一组是( )
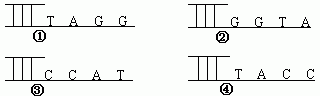 A.①② B.②③ C.③④ D.②④
A.①② B.②③ C.③④ D.②④
1.在遗传工程技术中,限制性内切酶主要用于 ( ) A.目的基因的提取和导入 B.目的基因的导入和检测 C.目的基因与运载体结合和导入 D.目的基因的提取和与运载体结合
23.(11分)某研究性学习小组对氨气的制法进行了如下设计:
(1)下面是该小组同学提出的实验室制备氨气的几种方案:
A.硝酸铵固体与氢氧化钠固体共热 B.加热分解NH4Cl晶体
C.将浓氨水逐滴加到新制的生石灰中
你认为其中较为简便易行的方案有_________(填写字母);其反应的化学方程式为
________________________________________________________________。
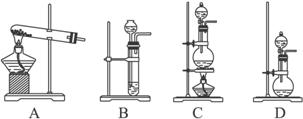
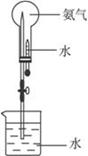
 请从上图的仪器中选择制取氨气的发生装置(要求仪器少、合理)__________(写编号)。
请从上图的仪器中选择制取氨气的发生装置(要求仪器少、合理)__________(写编号)。
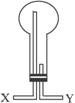
(2)该小组需收集干燥后的氨气:①如选用右图所示的装置,则气体
|
22.(11分)已知物质A-M有下图所示的关系,且常温下,A、M为黄色或浅黄色固体,G为黑色固体,B、K为气体单质,E、F、H为液体;D气体能使澄清的石灰水产生白色沉淀;D、K的水溶液都具有漂白性,但两者混合后不一定具有漂白性;组成F、M的元素共有三种,但F、M都只由两种元素组成,且两元素的原子个数之比均为1:1。
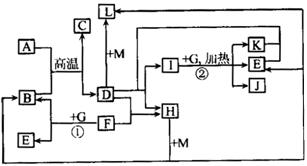
试回答下列问题:
(1)M中阴、阳离子数之比为:_______________;
(2)G在反应①,②中分别作_______________剂和_______________剂;
(3)写出下列反应的化学方程式:
A+B→C+D:________________________________________________,
D+M→L:__________________________________________________,
(4)写出下列反应的离子方程式:
K+E+D→I+H:________________________________________________,
I+G→K+E+J:_________________________________________________。
21.(8分)有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表
示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一
定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知
乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:

请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,工业上保存A的方法为________________。
(2)写出下列化学用语:
用电子式表示乙分子的形成过程__________________________________________,
戊分子的结构式是______________,甲和丙反应产物的电子式 _______________。
(3)写出下列反应的化学方程式:
丙+丁→D + 乙:_____________________________________________
A+丙→D + 甲:____________________________________________
20.(15分)碳和硅的性质相似。碳的最简单的氢化物为甲烷,硅的最简单的氢化物为甲硅烷(SiH4)。甲硅烷是一种无色无味的气体(其密度比空气大),不易溶于水,其化学性质比甲烷活泼。在实验室里制取甲硅烷的方法是:将白净的细沙(SiO2)与镁粉混合起来,灼烧反应物转变为灰黑色的硅化镁(Mg2Si)和白色的氧化镁后冷却到室温,然后取一定量的灼烧后的残留物,置于制取甲硅烷的装置中,滴加稀盐酸后立即有甲硅烷气体逸出,并迅速地自燃。
(1)写出上述制取甲硅烷的化学方程式。
(2)制取甲硅烷的装置与制取________(填“氧气”“氢气”或“氯气”)的装置相似。
(3)加入稀盐酸之前应向密闭装置中通入一会儿氮气,其目的是_____________________。
(4)收集甲硅烷气体只能采用__________法,这是因为____________________。收集完甲硅烷气体后不能直接将导气管从水槽中取出,这是为了防止________________,正确的操作方法是____________________________________________________________________。
(5)为了研究甲硅烷的化学性质,进行如下实验:
①将甲硅烷通入少量的高锰酸钾酸性溶液中,发现有二氧化锰生成,同时还生成了所有气体中最轻的气体,然后经测定得知所得溶液为无色的硅酸钾(K2SiO3)溶液,该反应的化学方程式为_______________________________________________。
②将甲硅烷通入少量的硝酸银溶液,发现有沉淀生成,然后经测定得知沉淀为混合物,其中有二氧化硅。向充分反应后的溶液中滴入几滴稀盐酸,未发现有白色沉淀生成;向反应后的原溶液中滴入几滴碳酸钠溶液,却发现有气泡迅速放出。则将甲硅烷通入硝酸银溶液中,发生反应的化学方程式为________________________________________________。
(6)制完甲硅烷后,检验装置中是否有残留的甲硅烷的方法是_________________________
____________________________________________________________________。
19.Ⅰ.(4分)将98%的浓硫酸(密度1.84 g·cm-3)敞口露置于空气中,若干时间后,取出5 mL与18 mL 9 mol·L-1的NaOH溶液恰好完全中和。试回答:
(1)露置若干时间后的硫酸的物质的量浓度是_____________mol·L-1。
(2)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的的是__________________。
A.常温下加入铜片 B.常温下加入铁片 C.常温下加入木炭
D.用玻璃棒各蘸取一滴涂在纸上 E.分别滴到CuSO4·5H2O上
F.分别加入到盛有少量水的小烧杯中
Ⅱ.(7分)工业用接触法制硫酸,请回答下列问题:
(1)在接触室中生成SO3反应条件的选择,可以完全用勒夏特列原理解释的是______。
A. 用V2O5作催化剂 B. 温度为400℃-500℃
C. 常压 D. O2过量
(2)在硫酸工业的尾气中,______是主要大气污染物,必须进行净化处理,处理方法可采用过量氨水吸收,反应的离子方程式是_____________________________________。
(3)现有含FeS2 60%的黄铁矿100 t,如果在煅烧的过程中,有18%的硫损失了,则可生产质量分数为98%的硫酸 t。
18.铁粉和铜粉的均匀混合物,平均分成四等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
④ |
|
稀硝酸体积/Ml |
100 |
200 |
300 |
400 |
|
剩余金属/g |
18.0 |
9.6 |
0 |
0 |
|
NO体积/mL |
2240 |
4480 |
6720 |
V |
下列计算结果正确的是
A.硝酸的浓度为4 mol·L-1 B.①中溶解了5.6 g Fe
C.②中溶解了9.6 g Cu D.④中V=6720
班级 姓名
第Ⅱ卷(非选择题,共56分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com