
12.对于SO2和CO2说法正确的是 ( )
A. 都是直线形结构 B. 中心原子都采用SP杂化轨道
C. S原子和C原子上都没有孤对电子 D. SO2为V形结构,CO2为直线形结构
11.下列含有极性键的非极性分子是 ( )
(1)CCl4(2)NH3(3)CH4(4)CO2(5)N2(6)H2S (7)SO2(8)CS2(9)H2O(10)HF
A.(1)(3)(4)(8) B.(1)(3)(4)(5)(8)
C.(2)(3)(4)(5)(8) D.以上均不对
10.下列关于晶体的叙述中,错误的是 ( )
A.每摩尔Si晶体中,含有2摩尔Si-Si共价键
B.在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子
C.在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+
D.在简单立方堆积的金属晶体中,每个金属原子周围紧邻的有6个金属原子
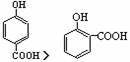
9.下面的排序不正确的是 ( )
A.晶体熔点的高低: 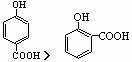 >
>
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小: NaF> NaCl> NaBr>NaI
8.下列说法正确是 ( )
①所有基态原子核外电子排布都遵循构造原理
②同一周期从左到右,元素第一电离能、电负性都是越来越大
③所有化学键和氢键都具有相同特征:方向性和饱和性
④所有配合物都存在配位键,所有含配位键的化合物都是配合物
⑤所有含极性键的分子都是极性分子
⑥所有离子晶体中都含有离子键
⑦所有金属晶体熔点肯定高于分子晶体
A.①② B.⑥ C.③④⑤ D.①②⑥
7.下列分子或离子中键角由大到小排列顺序是 ( )
①BF3 ②NH3 ③H2O ④NH4+ ⑤BeCl2
A.⑤④①②③ B.⑤①④②③ C.④①②⑤③ D.③②④①⑤
6.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是 ( )
A.S和Si B.CCl4和KCl C.NaCl和HCl D.CO2和H2O
5.下列式子中,真实表示物质分子组成的是 ( )
A.H2O B.NH4Cl C.SiO2 D.C
4.根据等电子原理,等电子体之间结构相似、物理性质也相近。以下各组粒子不能互称为等电子体的是( )
A.CO和N2 B.O3和SO2
C.CO2和N2O D.N2H4 和C2H4
3.下列性质中,可以较充分说明某晶体是离子晶体的是 ( )
A. 具有较高的熔点 B. 固态不导电,水溶液能导电
C. 固态不导电,熔融状态能导电 D.可溶于水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com