
30.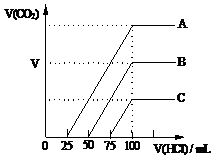 (6分)取等物质的量浓度的NaOH溶液A、B、C三等份各100 mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2 mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示。试
(6分)取等物质的量浓度的NaOH溶液A、B、C三等份各100 mL,分别向三份溶液中通入不等量的CO2气体,充分反应后,再向三份所得的溶液中逐滴加入0.2 mol/L的盐酸,标准状况下产生的CO2气体体积与所加盐酸的体积之间的关系如图所示。试 回答下列问题:
回答下列问题:
(1)原NaOH溶液的浓度为 mol/L;
(2)曲线B表明,原NaOH溶液中通入的
CO2的体积为 mL ;
(3)曲线C表明,原NaOH溶液中通入CO2
后,所得溶液中的溶质成分的物质的量
之比为 。
29.(4分)某化工厂排放的废水中含氯总量以Cl2 计为0.01mol/L。该厂欲配制固体试剂(Na2SO3与NaOH的混合物)一次性除去Cl2并使溶液呈中性。试计算:
(1)所配固体试剂中NaOH的质量分数;
(2)若该厂每天排放废水100m3,每天处理废水需该固体的质量(kg)。
28.(12分)下列为实验室常见的气体制取、干燥和收 集装置。
集装置。

(1)若用以上装置制取并收集干燥的NH3,则添加液态试剂的仪器的名称是________,仪器的连接顺序为a→________________________;
(2)若用A装置制取O2,则选用的液态药品的电子式为________或_______;
(3)若用A装置制取NH3与O2的混合气体,若液态物质选用浓氨水,则选用的固体药品的名称是________,反应的化学方程式为
__________________________________________________________________。
27、(2分)下列有关实验操作或判断正确的是_________(填序号)。
a.用溴水除去乙烯中混有的二氧化硫气体
b.分液时,分液漏斗中下层液体从下口流出,上层液体从上口倒出
c.用托盘天平称取10.50g的干燥的NaCl固体
d.用pH试纸直接蘸取溶液测定pH
e.配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分
26.(8分)阿斯匹林是一种常见的OTC药物,常用于治疗因感冒引起的头痛发热。阿斯匹林可按下列流程合成。

试回答:
(1)有机物C的结构简式为________________;
(2)以上反应中属于氧化反应的反应有②和__________(填编号);
(3)反应①的化学方程式为________________________________________;
(4)任写一种E的属于酯类的同分异构体________________。
25.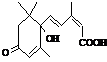 (4分)国庆60年期间,天安门广场的大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开。S-诱抗素的分子结构如右图:
(4分)国庆60年期间,天安门广场的大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开。S-诱抗素的分子结构如右图:
(1)对S-诱抗素制剂分类不正确的是 ;
a.烃类 b.醇类 c.羧酸类
(2)1 mol S-诱抗素制剂与足量金属钠反应,最多消耗钠的物质的量是 。
24.(10分)X、Y、Z、W四种短周期元素的原子序数依次增大,它们之间可以相互形成等电子数的A2B2型、AB型、A2型、A22-型等微粒。
(1)若A22-型微粒的电子数为14时:
① 写出上述A2型微粒的结构式 _______________;
② 写出四种元素原子按5∶1∶1∶3形成的离子化合物与足量NaOH反应的离子方程式 ;
(2)若A2型微粒为最活泼的非金属单质时:
① 1mol A2B2型化合物分解转移电子的物质的量为 ;
② 写出一种具有相同电子数的 有机物的化学式
;
有机物的化学式
;
③ 比较Z与W两种元素的氢化物的沸点 。
23.(10分)A、B、C、X均为中学常见物质,它们有如下转化关系(副产物已略去)。
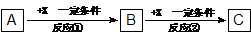
试回答:
(1)若A为气态化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色,该转化关系是工业制硝酸的反应原理,则A空间结构是 。
(2)若X是强氧化性单质,则A不可能是_______________;
a.S b.N2 c.Na d.Mg
(3)若X是金属单质,将5~6滴B的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应。C溶液在贮存时应加入少量X,理由是(用离子方程式表示) ;
(4)若A、B、C含同种金属元素,X为强电解质,则A溶液与C溶液反应生成B的离子方程式为_________________________________________________________,
X的化学式可能为________。
22.在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A.25℃时,CuS的溶解度大于ZnS的溶解度
B.25℃时,饱和CuS溶液中,Cu2+的浓度为1.3×10-36 mol/L
C.因为H2SO4是强酸,所以Cu2++ H2S = CuS↓+ 2H+ 不能发生
D.除去某溶液中的Cu2+,可以选用FeS作沉淀剂
第Ⅰ卷答题处(请将正确答案前面的字母填入下表相应的空格内)
登分栏(由评卷教师填写)
|
座位号 |
|
|
|
|
第Ⅱ卷(非选择题,共56分)
21.已知某化学反应的平衡常数表达式为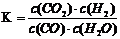 ,在不同的温度下该反应的平衡常数如下表:
,在不同的温度下该反应的平衡常数如下表:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
1.67 |
1.11 |
1.00 |
0.60 |
0.38 |
下列有关叙述不正确的是
A.该反应的化学方程式是CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.若在一定体积的密闭容器中通入CO2和H2各1mol,5 min后温度升高到830℃,此时测得CO2为0.4 mol时,该反应达到平衡状态
D.若平衡浓度符合下列关系式: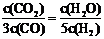 ,则此时的温度为1000℃
,则此时的温度为1000℃
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com