
11.(14分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:Y+X→A(气),Y+Z→B(气)。请针对以下两种情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是 ;
②生成固体C的化学方程式是 。
(2)若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式是 ;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式
是 ;
③将B与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式
是 。
10.(14分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[滴定时,1mol (CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1-2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
 ②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
|
滴定次数 |
待测溶液的体积/mL |
标准溶液的体积 |
|
|
滴定前刻度/mL |
滴定后刻度/mL |
||
|
1 |
25.00 |
1.02 |
21.03 |
|
2 |
25.00 |
2.00 |
21.99 |
|
3 |
25.00 |
0.20 |
20.20 |
若NaOH标准溶液的浓度为0.1010m01·L-1,则该样品中氮的质量分数为 。
9. (14分)黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
(14分)黄铁矿主要成分是FeS2 。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量‘Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O == SO42- + 2Fe2+ + 4H+
Cr2O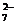 + 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ == 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4 ,放出13.03 kJ热量,写出SO3气体转化为H2SO4
的热化学方程式
___________________________________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
7.咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下所示:关于咖啡鞣酸的下列说法不正确的是( ) 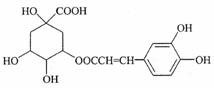
A.分子式为C16H18O9
B.与苯环直接相连的原子都在同一平面上
C.咖啡鞣酸水解时可消耗8molNaOH
D.与浓溴水既能发生取代反应又能发生加成反应
[i]8.某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50mL bmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是( )
A 若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B 若金属全部溶解,则溶液中一定含有Fe3+
C 若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D 当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b>80y(1-a/3)
Ⅱ卷(共60分)
6.灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s、灰)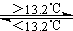 Sn(s、白) △H3=+2.1kJ/mol
Sn(s、白) △H3=+2.1kJ/mol
下列说法正确的是( )
A △H1>△H2
B 锡在常温下以灰锡状态存在
C 灰锡转化为白锡的反应是放热反应
D 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏
5.下列实验的失败是因为缺少必需的实验步骤造成的是( )
①锌与稀硫酸反应制取氢气,用排水法收集不到氢气; ②实验室用无水乙醇和浓H2SO4共热140℃制乙烯时得不到乙烯; ③验证RX是碘代烷,把RX与NaOH水溶液混合后,加入AgNO3溶液出现褐色沉淀; ④做醛的还原性实验时,当加入新制的Cu(OH)2悬浊液后,未出现红色沉淀; ⑤检验淀粉已水解,将淀粉与少量稀H2SO4加热一段时间后,加入银氨溶液后未出现银镜。
A.①②③④⑤ B.①③④⑤ C.③④⑤ D.③⑤
4.25℃时两个铂电极插入一定量的Na2SO4饱和溶液中进行电解,通电一段时间后,在阴极逸出a mol气体,同时有w g Na2SO4·10 H2O晶体析出,若温度不变,则剩余溶液的质量分数为( )
A.(w/w+18a)×100% B. (w/w+36a)×100%
C. 7100w/161(w+18a)% D.7100w/161(w+36a)%
3.在温度相同相同的物质的量的浓度的两种一元弱酸的钠盐溶液中分别通入少量的CO2,发生如下反应:
①NaR+ CO2+ H2O=HR+NaHCO3;
②2 NaR′+ CO2+ H2O=2HR′+Na2CO3.下列说法正确的是( )
A. HR′的酸性比HR的强
B.同物质的量浓度溶液的碱性强弱: NaR′>Na2CO3> NaR >NaHCO3
C相同条件下, HR与NaR溶液中水的电离程度: HR>NaR
D. pH相同、体积也相同的HR与HR′溶液中和碱的能力HR >HR′
2.下列各种情况下,溶液中可能大量存在的离子组是( )
A.使pH试纸呈红色的溶液中:I-、Cl-、ClO-、Na+
B.澄清透明的溶液中:K+、Fe2+、NO3-、ClO-
C.由水电离出的c(H+)=l×10-12mol/L的溶液中:K+、Na+、Cl-、SO32-
D.含有较多的Al3+的溶液中:K+、Ca2+、HCO3-、Cl-
1.下列说法正确的是( )
A.离子晶体中可能含有共价键,但不一定含有金属元素
B.1 mol H2SO4与1 molBa(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
C.0.5mol·L-1CuCl2溶液中含有0.5NA个Cu2+
D.对于组成结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com