
1、 自感--由于导体本身的电流变化而产生的电磁感应现象叫自感现象。 产生的电动势叫自感电动势。电流I变化时,自感电动势阻碍电流的变化(当I增加,自感电动势反抗I的增加,当I减小,自感电动势补充I的减小)
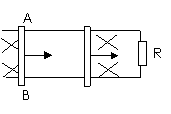 把AB向右移动一段距离,AB长L,速度v,匀强磁场B
把AB向右移动一段距离,AB长L,速度v,匀强磁场B
当B⊥L,L⊥v,B⊥v时有

|
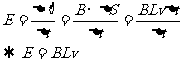
推广:已知:B,L,ω 求:E=?
例题举例:
[例1]如图所示,长L1宽L2的矩形线圈电阻为R,处于磁感应强度为B的匀强磁场边缘,线圈与磁感线垂直。求:将线圈以向右的速度v匀速拉出磁场的过程中,⑴拉力F大小; ⑵拉力的功率P; ⑶拉力做的功W; ⑷线圈中产生的电热Q ;⑸通过线圈某一截面的电荷量q 。
解:⑴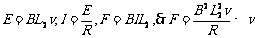 ⑵
⑵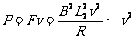
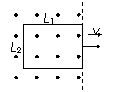 ⑶
⑶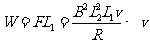 ⑷
⑷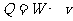
⑸ 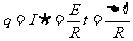 与v无关
与v无关
注意电热Q和电荷q的区别,其中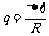 与速度无关!(这个结论以后经常会遇到)。
与速度无关!(这个结论以后经常会遇到)。
 [例2]如图,竖直放置的U形导轨宽为L,上端串有电阻R(其余导体部分的电阻都忽略不计)。磁感应强度为B的匀强磁场方向垂直于纸面向外。金属棒ab的质量为m,与导轨接触良好,不计摩擦。从静止释放后ab保持水平而下滑。试求ab下滑的最大速度vm
[例2]如图,竖直放置的U形导轨宽为L,上端串有电阻R(其余导体部分的电阻都忽略不计)。磁感应强度为B的匀强磁场方向垂直于纸面向外。金属棒ab的质量为m,与导轨接触良好,不计摩擦。从静止释放后ab保持水平而下滑。试求ab下滑的最大速度vm
解:释放瞬间ab只受重力,开始向下加速运动。随着速度的增大,感应电动势E、感应电流I、安培力F都随之增大,加速度随之减小。当F增大到F=mg时,加速度变为零,这时ab达到最大速度。
由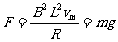 ,可得
,可得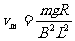
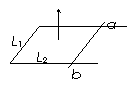 [例3] 如图所示,U形导线框固定在水平面上,右端放有质量为m的金属棒ab,ab与导轨间的动摩擦因数为μ,它们围成的矩形边长分别为L1、L2,回路的总电阻为R。从t=0时刻起,在竖直向上方向加一个随时间均匀变化的匀强磁场B=kt,(k>0)那么在t为多大时,金属棒开始移动?
[例3] 如图所示,U形导线框固定在水平面上,右端放有质量为m的金属棒ab,ab与导轨间的动摩擦因数为μ,它们围成的矩形边长分别为L1、L2,回路的总电阻为R。从t=0时刻起,在竖直向上方向加一个随时间均匀变化的匀强磁场B=kt,(k>0)那么在t为多大时,金属棒开始移动?
解:由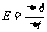 = kL1L2可知,回路中感应电动势是恒定的,电流大小也是恒定的,但由于安培力F=BIL∝B=kt∝t,随时间的增大,安培力将随之增大。当安培力增大到等于最大静摩擦力时,ab将开始向左移动。这时有:
= kL1L2可知,回路中感应电动势是恒定的,电流大小也是恒定的,但由于安培力F=BIL∝B=kt∝t,随时间的增大,安培力将随之增大。当安培力增大到等于最大静摩擦力时,ab将开始向左移动。这时有: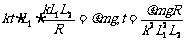
 [例4]如图所示,水平面上固定有平行导轨,磁感应强度为B的匀强磁场方向竖直向下。同种合金做的导体棒ab、cd横截面积之比为2∶1,长度和导轨的宽均为L,ab的质量为m ,电阻为r,开始时ab、cd都垂直于导轨静止,不计摩擦。给ab一个向右的瞬时冲量I,在以后的运动中,cd的最大速度vm、最大加速度am、产生的电热各是多少?
[例4]如图所示,水平面上固定有平行导轨,磁感应强度为B的匀强磁场方向竖直向下。同种合金做的导体棒ab、cd横截面积之比为2∶1,长度和导轨的宽均为L,ab的质量为m ,电阻为r,开始时ab、cd都垂直于导轨静止,不计摩擦。给ab一个向右的瞬时冲量I,在以后的运动中,cd的最大速度vm、最大加速度am、产生的电热各是多少?
解:给ab冲量后,ab获得速度向右运动,回路中产生感应电流,cd受安培力作用而加速,ab受安培力而减速;当两者速度相等时,都开始做匀速运动。所以开始时cd的加速度最大,最终cd的速度最大。全过程系统动能的损失都转化为电能,电能又转化为内能。由于ab、cd横截面积之比为2∶1,所以电阻之比为1∶2,根据Q=I 2Rt∝R,所以cd上产生的电热应该是回路中产生的全部电热的2/3。又根据已知得ab的初速度为v1=I/m,因此有: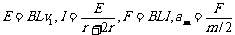 ,解得
,解得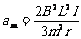 。最后的共同速度为vm=2I/3m,系统动能损失为ΔEK=I 2/ 6m,其中cd上产生电热Q=I 2/ 9m
。最后的共同速度为vm=2I/3m,系统动能损失为ΔEK=I 2/ 6m,其中cd上产生电热Q=I 2/ 9m
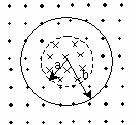 [例5]如图所示,空间存在垂直于纸面的均匀磁场,在半径为的圆形区域内部及外部,磁场方向相反,磁感应强度的大小均为B。一半径为,电阻为R的圆形导线环放置在纸面内,其圆心与圆形区域的中心重合。当内、外磁场同时由B均匀地减小到零的过程中,通过导线截面的电量____________。
[例5]如图所示,空间存在垂直于纸面的均匀磁场,在半径为的圆形区域内部及外部,磁场方向相反,磁感应强度的大小均为B。一半径为,电阻为R的圆形导线环放置在纸面内,其圆心与圆形区域的中心重合。当内、外磁场同时由B均匀地减小到零的过程中,通过导线截面的电量____________。
解析:由题意知:
,
,
由
[例6]如图所示是一种测量通电螺线管中磁场的装置,把一个很小的测量线圈A放在待测处,线圈与测量电量的冲击电流计G串联,当用双刀双掷开关S使螺线管的电流反向时,测量线圈中就产生感应电动势,从而引起电荷的迁移,由表G测出电量Q,就可以算出线圈所在处的磁感应强度B。已知测量线圈共有N匝,直径为d,它和表G串联电路的总电阻为R,则被测处的磁感强度B为多大?
解析:当双刀双掷开关S使螺线管的电流反向时,测量线圈中就产生感应电动势,根据法拉第电磁感应定律可得: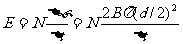
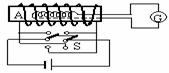 由欧姆定律得:
由欧姆定律得: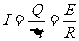
由上述二式可得: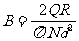
3、△Φ的产生方式:①改变B,②改变S,③、改变B和S的夹角
3、磁通量的变化率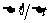 ――单位时间内的磁通量的变化
――单位时间内的磁通量的变化
|
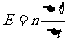
2、磁通量的变化量△Φ = Φ2 - Φ1
1、磁通量Φ――穿过某一面积的磁感线的条数
28、(4分)吸热反应N2(g)+O2 (g)  2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
2NO(g),在2000℃时,K=6.2×10-4.2000℃时,在10L密闭容器内放入3×10-3molNO、2.50×10-1molN2和4.00×10-2molO2,通过计算回答:(1)此反应的初始状态是否为化学平衡状态?
(2)若非化学平衡状态,反应将向哪个方向进行?

27、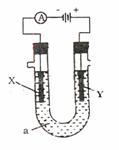 (7分)电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
(7分)电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出 mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度 。
26、(6分)请用学过的知识分析其中的化学原理并写出化学方程式,属于离子反应的请写出离子方程式。(1)将氯气通入熟石灰即可制的漂白粉[漂白粉的有效成分是次氯酸钙Ca(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质] 。(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质 。(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸 、
。(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用 。(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体:
25、(8分)水的电离平衡曲线如图所示。
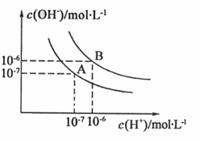 (1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从 变化到 。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为
。
(1)若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从 变化到 。(2)将PH=8的Ba(OH)2溶液与PH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的PH=7,则Ba(OH)2和盐酸的体积之比为
。
(3)已知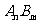 的离子积为
的离子积为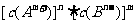 若某温度下
若某温度下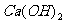 的溶解度为0.74g,设饱和溶液的密度为
的溶解度为0.74g,设饱和溶液的密度为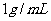 ,其离子积约为 。
,其离子积约为 。
(4)已知25℃时,0.1 L 0.1 mol·L-1的NaA溶液的pH = 10,则NaA溶液中所存在的离子的物质的量浓度由大到小的顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com