
1.物理性质
硫有 同素异形体。如单斜硫、斜方硫、弹性硫等。常温为 色晶体(淡黄色固体有: 等)。
2. 不同的卤素之间可以互相化合,形成一系列化合物,如IBr等,这类化合物称为卤素互化物,与卤素单质的性质相似。
与水反应:IBr+H2O
与碱反应:IBr+2NaOH 其中非金属性弱的卤素显 价。
其中非金属性弱的卤素显 价。
|
[特别提醒]:卤素互化物,与卤素单质的性质相似,具有较强的氧化性,如KBr+BrCl=KCl+Br2
SO2+2H2O+BrCl=HCl+HBr+H2SO4。 |
 [例4]卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
[例4]卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,XX’型卤素互化物与卤素单质结构相似、性质相近。试回答下列问题:
(1)卤素互化物BrCl能发生下列反应
H2O+BrCl=HBrO+HCl KBr+BrCl=KCl+Br2
①写出KI与IBr反应的化学方程式______________。
②写出苯与(C6H6)与ICl发生取代反应生成一卤代物的化学方程式_____________。
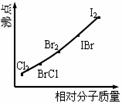
(2)右图是部分卤素单质和XX’型卤素互化物的沸点与其相对分子质量的关系图。它们的沸点随着相对分子质量的增大而升高,其原因是____________。
(3)试推测ICl的沸点所处的最小范围______________。
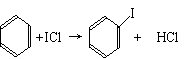 [解析]从题给信息可知:卤素互化物与卤素单质结构相似、性质相近,BrCl与Cl2相似,IBr与Br2相似。KI与IBr反应相当KI与Br2反应,方程式为:KI+IBr=KBr+I2。C6H6与ICl发生取代反应相当C6H6与Cl2发生取代反应,方程式为:C6H6+ICl→C6H5I+HCl。ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
[解析]从题给信息可知:卤素互化物与卤素单质结构相似、性质相近,BrCl与Cl2相似,IBr与Br2相似。KI与IBr反应相当KI与Br2反应,方程式为:KI+IBr=KBr+I2。C6H6与ICl发生取代反应相当C6H6与Cl2发生取代反应,方程式为:C6H6+ICl→C6H5I+HCl。ICl属分子晶体,相对分子质量(162.5)介于Br2和IBr之间,故ICl的沸点介于Br2和IBr之间。
[答案](1)①KI+IBr=KBr+I2
②C6H6+ICl→C6H5I+HCl;或
(2)相对分子质量越大,分子间作用力越强。(3)介于Br2的沸点和IBr的沸点之间
[规律总结]
“拟卤素”如:(CN)2、(SCN)2、(OCN)2、IBr等性质与卤素相似,表现在单质的氧化性、与碱溶液反应生成卤化物和次卤酸盐、与Ag+结合的生成物的难溶性等。但是,由于拟卤素的组成不是一种元素,其各元素的化合价有差别,在参加化学反应中价态的变化与卤素单质不完全相同,如IBr+H2O HBr+HIO的反应不属于氧化还原反应等。
HBr+HIO的反应不属于氧化还原反应等。
1. 与卤素单质的性质相似,其原子团是化合物中的阴离子,也有与卤素阴离子相似的性质。如:氰(CN)2 ,硫氰(SCN)2等物质,称为拟卤素。
可以和碱反应:(CN)2+2NaOH
与氧化剂反应:(CN)2+MnO2
2.卤素的检验
(1)氯气为黄绿色,有刺激性气味,并可使某些潮湿的有色物质褪色。氯气具有强氧化性,可使湿润KI淀粉试纸呈现 色,因此可用于检验氯气的存在。
(2)利用碘单质能与淀粉溶液呈现 色的性质可用于检验碘单质的存在。
(3)AgCl、AgBr、AgI都不溶于稀HNO3,且颜色逐渐加深,分别为 色、 色、
色,所以,可用 溶液来检验Cl-、Br-、I-的存在。
(4)也可以用卤素单质间的置换反应和有机溶剂萃取的方法来检验卤素单质。
|
[特别提醒]:检验X-时,要先加稀HNO3酸化,以排除CO32-、PO43-等离子的干扰。 |
[例3](2007年上海)今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01mol CO32-
C.Cl-可能存在 D.Ba2+一定不存在,Mg2+可能存在
[解析]加入NaOH溶液加热后有气体产生,说明溶液中含NH4+;加足量BaCl2溶液后有沉淀产生,说明溶液中含CO32-或SO42-或CO32-、SO42-均有,经盐酸洗涤、干燥后,沉淀部分溶解,故CO32-、SO42-均有。因溶液中含CO32-、SO42-,故不含Mg2+、Ba2+;从实验(3)可见,溶液中含SO42-0.01mol,含CO32-0.02mol,从实验(2)得知,溶液中含NH4+0.04mol,故应还最少含K+0.02mol,Cl-可能存在也可能不存在。
[答案]AC
[误区警示]用AgNO3溶液检验卤素离子,必须加入少量稀硝酸,观察沉淀不溶解。只能加少量稀硝酸,不能加浓硝酸,也不能硝酸过量,更不能用盐酸或硫酸酸化。因为除了AgX产生沉淀外,还有Ag2SO3和Ag3PO4会产生白色或浅黄色沉淀,加硝酸的目的就是这些银盐会溶于酸以排、去干扰。不能用盐酸,硫酸酸化,因为这些就本身会生成银盐沉淀,硝酸不能多,也不能浓,因为硝酸多了,会把SO32-氧化成SO42-,这样又会造成新的错觉,把SO32-当成了卤离子。这个方法不能检验F-,因为AgF会溶于水。
考点4 卤素互化物与拟卤素
1.卤素及化合物的特性
卤族元素是最外层电子数最多的主族元素,卤族是唯一全部由非金属元素构成的元素族,卤素的非金属性比同周期其他元素都强。
(1)氟是 的非金属,单质的氧化性 ,氟离子(F-)很难被氧化。氟元素在化合物中化合价只有 , 正价,常温下氟气与水剧烈反应且 其他卤素(产物不同,原理不同), 从其他卤化物的水溶液中置换出其他卤素(先与水发生置换反应),能与稀有气体反应(常见的产物均为白色)。
(2)溴在常温下为 色液体(唯一液态非金属单质),极易挥发产生红棕色且有毒的溴蒸气。实验室通常将溴密闭保存在 处,且在试剂瓶中加 进行液封,不能用 。
(3)碘是 色固体,具有金属光泽,易升华(常用于 )、易吸潮(遇铁在水催化下易反应,故盛碘的瓶子不能用铁盖),使淀粉变 色(常用来检验碘的存在),碘的氧化性较其他卤素弱,与变价金属铁反应生成 而不是 。
(4)氢氟酸为 酸,有剧毒, 腐蚀玻璃,实验室中常用 容器保存。AgF易溶于水,无感光性,其他卤化银难溶于水,具有感光性。
2.工业制法:电解饱和食盐水: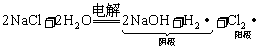
|
[特别提醒]:本实验中盐酸要过量,因随着反应的进行,盐酸的浓度降低,而MnO2与稀盐酸不反应,则反应中盐酸不可能完全消耗。 |
 [例2]已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
[例2]已知KMnO4与浓HCl在常温下反应能产生Cl2。若用右图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处
C.②和③处 D.②③④处
[解析]由KMnO4与浓HCl在常温下反应能产生Cl2知①正确;反应放热,浓HCl易挥发,故产生的Cl2中可能混有HCl,需要净化,洗液不能用NaOH,因为NaOH能和Cl2反应,应该用饱和食盐水,②错误;净化后的Cl2可以用浓H2SO4干燥,但气体应用长导管直接通入浓H2SO4中,③错误;干燥的氯气和金属反应的容器只有气体进入的导管,一段时间后压强升高,可能会使橡皮塞弹开,④错误。故D选项符合题意。
[答案]D
[规律总结]实验室制取气体方法及装置的选择依据
(1)选取试剂的主要依据是制取气体的性质,如氯气具有氧化性,常用氧化其离子的方法来制取,因此要选用含有氯离子的物质(如盐酸)和具有氧化性的物质(如MnO2、KMnO4等)来制取。
(2)选取发生装置的依据是制取气体所用试剂的状态和反应条件(加热与否)。如实验室用:2NaCl+3H2SO4+MnO2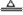 2NaHSO4+MnSO4+2H2O+C12↑法制取氯气,也是加热固体与液体的混合物,以此分析可知,所以它们的发生装置相同。
2NaHSO4+MnSO4+2H2O+C12↑法制取氯气,也是加热固体与液体的混合物,以此分析可知,所以它们的发生装置相同。
考点3 卤素及化合物的特性与卤素的检验
1.实验室制法
(1)反应原理: 。
说明:①若没有浓盐酸时,可用 代替; ②若没有MnO2时可用 代替,此时可不加热。另外KClO3、K2Cr2O7、Ca(ClO)2、PbO2等也可代替MnO2;③加热温度不宜过高,否则制得的Cl2中HCl气体杂质较多。
(2)发生装置:用分液漏斗、圆底烧瓶等组装的典型固液加热制气装置。
(3)气体的净化与干燥:C12的净化用 或 洗气,除去混在C12中的HCl气体;用 干燥。
(4)收集: 法或排 法(饱和食盐水可除去Cl2中的HCl气体)。
(5)气体的检验:用 检验。
(6)尾气处理:用 吸收多余的Cl2,以防Cl2污染大气。
2.Cl2+H2O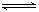 H++Cl-+HClO平衡移动的应用
H++Cl-+HClO平衡移动的应用
|
向氯水中加入 的物质 |
浓度变化 |
平衡移动 的方向 |
应 用 |
|
可溶性氯化物 |
c(Cl-) |
|
①用饱和食盐水除Cl2中的HCl②用排饱和食盐水法收集Cl2 |
|
盐酸 |
c(H+)和c(Cl-) |
|
次氯酸与浓盐酸反应制Cl2 |
|
NaOH |
c(H+) |
|
用NaOH溶液吸收多余的Cl2 |
|
Ca(OH)2 |
c(H+) |
|
制漂白粉 |
|
CaCO3 |
c(H+) |
|
制高浓度HClO溶液 |
|
光照 |
c(HClO) |
|
氯水闭光保存或现用现配 |
[特别提醒]:Cl2+H2O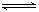 H++Cl-+HClO平衡移动的各种情况均可归结到勒夏特列原理,故掌握知识要“以不变应万变”。 H++Cl-+HClO平衡移动的各种情况均可归结到勒夏特列原理,故掌握知识要“以不变应万变”。 |
[例1](2009届龙岩一中第一学段考试)下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的 ( )
A.将NaHCO3固体加入新制氯水,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈血红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl-)
[解析]氯水中存在H+,与NaHCO3反应产生CO2,与H+相关;氯水使红色布条褪色是因为氯水中存在HClO,而不是因为氯水中存在HCl;氯水中存在Cl2能氧化Fe2+→Fe3+,故滴加KSCN溶液,溶液呈血红色;氯水中存在Cl-能与AgNO3溶液生成白色沉淀。
[答案]B
[方法技巧]解此题的关键是掌握氯水中含有的各种粒子以及他们对应的性质。强酸性--H+的性质;漂白性--HClO的性质;强氧化性--Cl2、HClO的性质。
考点2 氯气的制法
1.氯水的成分和性质
|
成分 |
表现的性质 |
反应实例 |
|
|
Cl2 |
①呈黄绿色 ②强氧化性 ③加成反应 |
Cl2+Mg Cl2+2KI Cl2+2KI
Cl2+H2SO3+H2O 
Cl2+CH2=CH2→ |
|
|
H+ |
强酸性 |
2H++CaCO3
|
滴入紫色石蕊试液先 ,后 |
|
HClO |
①弱酸性 ②强氧化性 |
HClO+OH- ClO-+H2O ClO-+H2O漂白、杀菌、消毒 |
|
|
Cl- |
沉淀反应 |
Cl-+Ag+ AgCl↓ AgCl↓ |
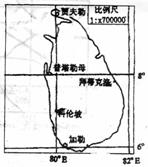 26.右图是南亚的斯里兰卡岛略图,由于不小心把比例尺的一个数字X弄模糊了,请根据以下条件并结合所学知识完成以下各题:
26.右图是南亚的斯里兰卡岛略图,由于不小心把比例尺的一个数字X弄模糊了,请根据以下条件并结合所学知识完成以下各题:
(1)量得普塔勒母与加勒图上距离约为3.3厘米,请计算机比例尺弄模糊了的数字X是 。
(2)一探险队计划在6月23日从首都科伦坡出发,横穿岛屿,6月27日到达拜蒂克洛,该探险队的行程总方向是 ,行程中正午太阳高度的变化是 。昼夜长短的变化是 。
27.读某地区等高线地形图,回答下列各题。
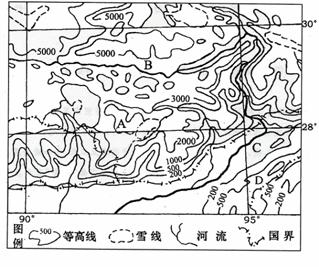
(1)图中A山脉形成的原因是 。
(2)图中B谷地名称是 谷地;该地最主要粮食作物是 ;
(3)图中C地降水丰富,主要粮食作物是 ;D地主要经济作物是 。
(4)图中95°经线及其附近B河流水能资源丰富的原因是:
① ;
② 。
(5)你是否赞同在这一河段修建水电站,并提出你的理由。
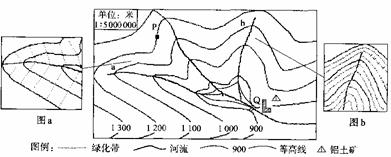 28.下图为我国山西省某地区示意图。据图回答下列问题:
28.下图为我国山西省某地区示意图。据图回答下列问题:
(1)若大气降水降落在P点后形成坡面径流,请在图中画出P点的径流方向。
(2)Q地区建成一座水电站,蓄水位保持在海拔900米,水库蓄水后的回水淹没的干流河段大约是 千米。若干年后,a河、b河洪水危害加剧,原因是:
。
(3)当地政府大力提倡植树造林,a河、b河流域采取了不同的植树造林模式(如图a,图b)。判断能够产生更大环境效益的模式并叙述其理由。
(4)简述Q城市兴起的主要区位因素。从促进该地区经济发展来看,今后更有利于哪些产业部门的发展?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com