
1.垃圾是放错了地方的资源。在循环经济大潮的推动下,我国越来越多的企业开始从垃圾中寻找财富,一些昔日的废物如今变成了抢手货。材料中变成抢手货的“垃圾”( )
A.不是商品,因为它是废弃物品 B.不是商品,因为它没有价值
C.是商品,因为它供不应求
D.是商品,因为它能制造有用物品且凝结了一般人类劳动
24.(8分)将标准状况下4.48 L的CO2通入适量的NaOH溶液充分反应后,溶液中生成盐的质量为19.0 g。
(1)若要使生成的盐的质量变为25.2 g,应继续向溶液中通入标准状况下CO2 g。
(2)向生成的19.0 g的盐溶液中加入一定量某物质,充分反应后,减压低温蒸发得到纯净的21.2 g Na2CO3固体。则:
①若只能加入0.05 mol某物质,则加入的物质可以是 或 。
②若只能加入0.10 mol某物质,则加入的物质可以是 或 。
湖北省黄冈中学2010届高三年级9月月考
23.(6分)在一定条件下,使H2和O2的混合气体26 g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2 g。求原混合气体中O2和H2的质量。
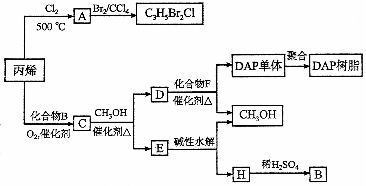
22.(14分)丙烯可用于合成杀除根瘤线虫的农药(分子式为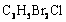 )和应用广泛的DAP树脂:
)和应用广泛的DAP树脂:
已知酯与醇可发生如下酯交换反应:
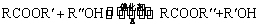 (R、
(R、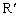 、
、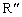 代表烃基)
代表烃基)
(1)农药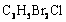 分子中每个碳原子上均连卤原子。
分子中每个碳原子上均连卤原子。
①A结构简式是 ,A含有的官能团名称是 ;
②由丙烯生成A的反应类型是 。
(2)A水解可得到D,该水解反应的化学方程式是 。
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%。C的结构简式是 。
(4)下列说法正确的是(选填序号字母) 。
a.C能发生聚合反应、还原反应和氧化反应
b.C含有2个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E具有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环利用于DAP树脂的制备。其中将甲醇与H分离的操作方法是 。
(6)F的分子式为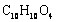 。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是 。
。DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种。D和F反应生成DAP单体的化学方程式是 。
21.(4分)现有分子式均为C3H6O2的四种有机物A、B、C、D,且分子中均含甲基,把它们分别进行下列实验以鉴别之,其实验记录如下:
|
|
NaOH溶液 |
银氨溶液 |
新制Cu(OH)2 |
金属钠 |
|
A |
中和反应 |
-- |
溶 解 |
产生氢气 |
|
B |
-- |
有银镜 |
加热后有红色沉淀 |
产生氢气 |
|
C |
水解反应 |
有银镜 |
加热后有红色沉淀 |
-- |
|
D |
水解反应 |
-- |
-- |
-- |
则A、B、C、D的结构简式分别为: A ,B , C ,D 。
20.(12分)以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出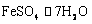 。
。
Ⅱ.将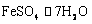 配制成溶液。
配制成溶液。
Ⅲ.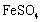 溶液与稍过量的
溶液与稍过量的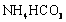 溶液混合,得到含
溶液混合,得到含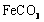 的浊液,同时有CO2气体
的浊液,同时有CO2气体
放出。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到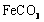 固体。
固体。
Ⅴ.煅烧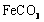 ,得到
,得到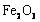 固体。
固体。
已知: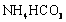 在热水中分解。
在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的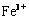 ,该反应的离子方程式是 。
,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成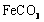 的离子方程式是 。若
的离子方程式是 。若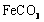 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验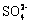 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验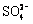 的操作是 。
的操作是 。
(5)已知锻炼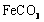 的化学方程式是
的化学方程式是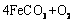

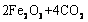 。现锻炼464.0kg
。现锻炼464.0kg
的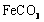 ,得到316.8kg产品。若产品中杂质只有
,得到316.8kg产品。若产品中杂质只有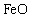 ,则该产品中
,则该产品中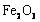 的质量是
的质量是
kg。
19.(6分)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料: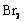 的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置
的沸点为59℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置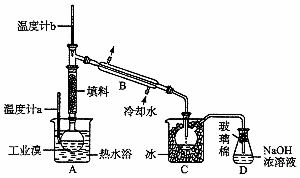 简图:
简图:
请你参与分析讨论:
(1)图中仪器B的名称: 。
(2)整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为 。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件: 。
(4)C中液体产物颜色为
______ ,为除去该产物中仍残留的少量Cl2,可向其中加入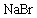 溶液,充分反应后,再进行的分离操作是 。
溶液,充分反应后,再进行的分离操作是 。
18.(4分)完成下列离子方程式(给出物质的计量数不能改变)
(1)1 +6H+ ═ 2Fe3+ + 3
(2)1 + 1Ca2+ + 2 ═ 1 CaCO3↓ + 1
17.(6分)高温下,向1mol 赤热的硫化亚铜中通入足量的水蒸气,生成2mol 氢气,同时还生成金属铜和一种刺激性气味的气体。
(1)该反应的化学方程式是________________________________________________。
(2)该反应中氧化产物是_______________。
(3)每生成1 mol H2氧化剂与还原剂之间转移的电子是______________mol。
16.在密闭容器中充入CO2和CO的混合气体,其密度是相同条件下氦气密度的8倍,这时测得容器内的压强为P1。若控制容器的体积不变,加入足量的Na2O2,充分振荡并不断用电火花点燃至反应完全,恢复到开始时的温度,再次测得容器内的压强为P2。则和P1和P2之间的关系是( )
A.P1=8P2 B.P1=4P2 C.P1=2P2 D.P1=P2
第Ⅱ卷(非选择题,共60分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com