
1. (10分)工业上制备BaCl2的工艺流程图如下:

某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查表得
BaSO4(s)
+ 4C(s) 4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
4CO(g) + BaS(s)
△H1 = 571.2 kJ·mol-1 ①
BaSO4(s)
+ 2C(s)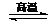 2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) △H2= 226.2 kJ·mol-1 ②
⑴气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
⑵向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,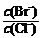 =
。
=
。
[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
⑶反应C(s) + CO2(g)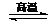 2CO(g)的△H2= kJ·mol-1。
2CO(g)的△H2= kJ·mol-1。
⑷实际生产中必须加入过量的炭,同时还要通入空气,其目的是
,
。
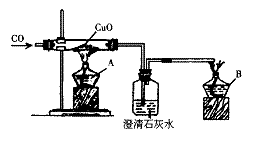
8.(10分)课题式课堂教学是研究性学习的一种方式,其基本教学模式为:
提出课题→确定研究方案→解决问题→总结和评价
下面关于“一氧化碳的化学性质”的课题式课堂教学中解决问题阶段甲同学设计的证明CO具有还原性的实验装置。
(1)点燃酒精灯A、B的先后顺序为:先_______________后______________。
(2)硬质试管中发生的反应的化学方程式为_______________ _____。
(3)洗气瓶中的实验现象为_____________________________________。
(4)酒精灯B的作用为________________________________。
 (5)乙同学提出甲装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导管出口旋转到A的火焰上即可。乙同学的设计是否合理?_________,简述理由(从A、B使用的一致性的角度考虑)_________________________。
(5)乙同学提出甲装置太复杂,可将酒精灯合二为一,去掉B,而将尾气导管出口旋转到A的火焰上即可。乙同学的设计是否合理?_________,简述理由(从A、B使用的一致性的角度考虑)_________________________。
(6)丙同学认为甲装置有待优化,如尾气可先储存在瓶内,然后再处理。右图是他设计的贮气瓶,尾气应从_________(选a、b填空)口通入。
(7)丁同学质疑:CO能否使澄清石灰水变浑浊?因此,其设计在CO通入CuO之前,应先通入澄清石灰水,以比较排除CO与澄清石灰水反应。试对此作出评价。你认为丁的设计是否必要___________________________,
理由是________________________________________________________。
7.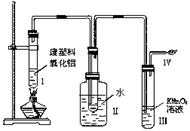 (7分)某研究性学习小组在研究塑料的降解时做了如下实验。装置如图:
(7分)某研究性学习小组在研究塑料的降解时做了如下实验。装置如图:
(1)写出你所知道的生成乙烯的化学方程式
。
(2)Ⅲ中的现象是 ,Ⅳ中的反应方程式是 。
据此现象提出你在治理白色污染方面的设想:
6.(8分)某校化学课外活动小组对实验室两瓶失去标签的白色固体Na2SO4和NH4Cl进行鉴别,经讨论可行的实验方案有多种,请你设计四种实验方案加以鉴别。简要写出操作过程、现象和结论。
|
方案 |
操作过程 |
现象和结论 |
|
① |
|
|
|
② |
|
|
|
③ |
|
|
|
④ |
|
|
5.(12分)氧化二氯是黄棕色具有强烈刺激性的气体。它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1∶100)同时反应生成次氯酸溶液.制备出之后要冷却为固态才便于操作和贮存。制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO·HgCl2)。装置如图,铁架台和夹持仪器已略去。
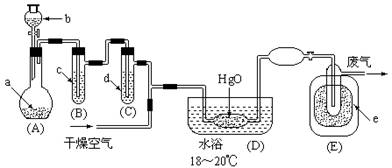 部分物质的有关物理数据如下:
部分物质的有关物理数据如下:
|
化学式 |
熔点(单位:℃) |
沸点(单位:℃) |
|
N2 |
-209.86 |
-195.8 |
|
O2 |
-218.4 |
-183 |
|
CO2 |
-57 |
/ |
|
NH3 |
-77.3 |
-33.35 |
|
Cl2 |
-101 |
-34.6 |
试回答: ①A中盛有深色固体试剂a是 ,分液漏斗中b试剂是 。
②B中盛有液体c是 ,C中的液体d是 。
③D中发生化学反应的化学方程式是 。
④E中的保温瓶中盛有致冷剂,它应是 (在干冰、冰水、液态空气、液氨中选择)。在E的内管得到的Cl2O中可能含有的主要杂质是 。
⑤装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是 ,用这些不同的连接方式的主要理由是 。
4.(3分)现有一瓶未知浓度的Ba(OH)2溶液、一瓶已知浓度的H3PO4溶液,还有酚酞试液、pH试纸、试管、胶头滴答等。
请设计一个最佳的实验方案,要求能够简便地判断Ba(OH)2溶液跟H3PO4溶液反应过程中恰好全部生成Ba3(PO4)2。
3.(7分)用实验确定某酸HA是弱电解质。两同学的方案是:
甲:① 称取一定质量的HA配制0.lmol/L的溶液100mL;
② 用pH试纸测出该溶液的pH值,即可证明HA是弱电解质。
乙:① 用已知物质的量浓度的HA溶液、盐酸,分别配制pH=l的两种酸溶液各100mL;
② 分别取这两种溶液各10mL,加水稀释为100mL;
③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HA是弱电解质的理由是测得溶液的pH 1(选填>、<、=)
乙方案中,说明HA是弱电解质的现象是 (多选扣分)
(a)装HCl溶液的试管中放出H2的速率快;
(b)装HA溶液的试管中放出H2的速率快;
(c)两个试管中产生气体速率一样快。
(3)请你评价:乙方案中难以实现之处和不妥之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述。
实验完成后,老师评议说:按上述实验设计,即使G中反应完全、D中吸收完全,也不会得出正确的结果。经讨论,有同学提出在B与G之间加入一个装置。再次实验后,得到了较正确的结果。那么,原来实验所测得的铜的质量分数偏小的原因可能是 ,在B与G之间加入的装置可以是 ,其中盛放的药品是 。
2.(4分)某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和二氧化锰的最佳催化温度均为500℃左右。于是对A和二氧化锰的催化性能进行了定量对照实验。实验时均以收满500mL氧气为准(其他可能影响实验的因素均已忽略)。
表一 用MnO2作催化剂
|
实验序号 |
KCIO3质量(g) |
MnO2质量(g) |
反应温度(℃) |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
表二 用A作催化剂
|
实验序号 |
KCIO3质量(g) |
MnO2质量(g) |
反应温度(℃) |
待测数据 |
|
1 |
8.00 |
2.00 |
500 |
|
|
2 |
8.00 |
2.00 |
500 |
|
请回答:上述实验中的待测数据应是 。
完成此研究后,他们准备发表一篇研究报告,请你替他们拟一报告的题目:
|
实验过程 |
实验现象 |
有关化学方程式 |
|
在C中加入样品标本W克,D中装入样品后并称量为m1克。连接好仪器后,检查气密性 |
|
|
|
打开A的活塞,慢慢滴加溶液 |
|
|
|
对G进行加热。当G中药品充分反应后。关闭A的活塞。停止加热 |
|
|
|
冷却后,称量D的质量为m2克。 |
|
|
仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶等
药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰、浓硫酸等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com