
20.n(NH4+)=bmol,n(SO42-)=cmol则n(NO3-)=bmol-2cmol
c(NO3-)=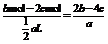 mol·L-1
mol·L-1
17.n(OH-)=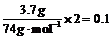 mol
mol
n(H3PO4)=0.15L×0.5mol/L=0.075mol
n(OH-)/n(H3PO4)=4/3,应生成Ca(H2PO4)2和CaHPO4两种盐。
16.该混合气体通过Na2O2后,当体积缩小为原混合气的一半时,应有V(CO2):V(NO)≥1:1。
14.CaCl2与CO2不反应;过量CO2与石灰水生成Ca(HCO3)2;Na2CO3与CO2反应生成溶解度较小的NaHCO3;Na2SiO3与CO2反应生成H2SiO3↓。
13.SiH4不稳定;H2S、HI还原性比NH3、HBr强;H2S、HF为弱酸,溶液的导电性较弱。
12.n(Si)=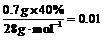 mol
mol
n(NaOH)=0.025mol(足量)
n(Fe)=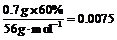 mol
mol
产生的H2总计为:n(H2)=0.0275mol
m(H2)=0.055g
9.设HNO3被还原后N元素的化合价为n价。
讨论:当金属为1价金属时,由2×1=1×(5-n)得n=3
当金属为2价金属时,由2×2=1×(5-n)得n=1
由此选C。
16.C 17.AB 18.B 19.B 20.B
7.硝酸能使CaCO3、Cu溶解,而不能与SiO2发生反应。
6.根据化合价升降法配平得:NO3-+4Zn+7OH-+6H2O=NH3+4Zn(OH)42-。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com