
5.氨水中有平衡:NH3·H2O NH4++OH-,加NH4Cl晶体,平衡逆向移动,C(OH-)减小。
NH4++OH-,加NH4Cl晶体,平衡逆向移动,C(OH-)减小。
讲析:3.分析反应过程CaCO3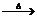 CO2
CO2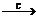 2CO
2CO
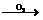 2CO2
2CO2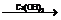 xCaCO3
xCaCO3
最后生成的CaCO3的量取决于Ca(OH)2的用量,应有0≤x≤2,因此CaCO3的质量在0~2mg之间。
4.SiO2与CaCO3恰好发生反应:
 CaCO3+SiO2 CaSiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
30.(10分)一块铜片投入一浓HNO3的试管中,充分反应后铜片有剩余,若将反应产生的气体用隔绝空气的方法收集,可得67.2mL(不计水蒸气)测得此气体对H2的相对密度为28,若将此气体与33.6mLO2混合后通入水中,经过足够长的时间后,水刚好充满整个容器,求此实验中铜片减轻了多少克?有多少克HN03被还原?(气体体积
均在标况下测得)
29.(6分)碳族元素R在它的化合物R(OH)n中,其质量分数为0.778,在它的另一种化合物R(OH)m中,其质量分数为0.636。
(1)试求n和m的值。
(2)试求R的相对原子质量a。
28.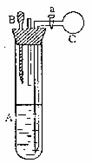 (9分)右图中,试管A内盛有2mL饱和石灰水,试管上端连有胶头滴管B,其中装有浓Na
(9分)右图中,试管A内盛有2mL饱和石灰水,试管上端连有胶头滴管B,其中装有浓Na
OH溶液,还连有一充满足量C02的气球C,气球与导管连接处有弹簧夹a夹紧。根据以下实验操作,填写下列空白:
(1)将滴管B中的溶液逐渐滴入试管
A中,有无明显现象发生 ,
原因 。
(2)打开a,将气球C中的气体逐渐用力全部挤压至试管A中,发生的现象是:
,
反应的离子方程式是:
。
(3)若从B中继续加入NaOH至过量,此时可见到的现象为:
,
反应的离子方程式为:
。
27.(8分)氮有多种氧化物,其中之一的N2O3极不稳定,在液体或蒸气中大部分分离成NO和NO2,因而在NO氧化为NO2的过程中几乎没有N2O3生成,同样亚硝酸也不稳
定,在微热甚至冷的条件下即分解。亚硝酸钠在中性或
碱性条件中是稳定的,但酸化后能氧化KI,生成I2和
NO气体。
(1) 亚硝酸分解的化学方程式是:
(2)酸性溶液中亚硝酸钠和碘化钾反应制取NO的离子
方程式是:
。
(3)在隔绝空气条件下,按下列操作制取NO:先取亚硝酸钠溶液适量加入稀盐酸片刻后,再加入KI溶液,试问这样的气体是否纯净?为什么?
。
26.(6分)下列各单质和化合物之间有以下转化关系。已知A是短周期元素单质,而且各单质和组成化合物的元素皆为短周期元素。
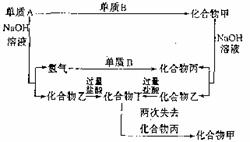
(1)单质A、B的化学式分别为:
A ,
B 。
(2)化合物甲、乙、丙、丁的化学式分别是:
甲 ,
乙 ,
丙 ,
丁 。
25.(11分)常温下有一种混合气体,可能由He、H2、O2、N2、NH3、NO、HCl、CO2等气体中的几种所组成,取200 mL混合气体进行如下实验:①将混合气体通过浓H2SO4体积减少40mL ②余下气体通过Na2O2固体容器中 充分反应后,体积又减少40mL ③将②剩余气体引燃后,再冷却到室温,气体体积减少105mL。 ④最后的剩余气体中有5mL是O2 ⑤整个反应过程中气体颜色无变化。试回答:
(1) 混合气体一定有哪些气体?各占多少mL?
。
(2) 混合气体中一定没有哪些气体?
。
(3) 混合气体中可能有哪些气体?
。
24.(6分)磷酸的结构式可以表示为 ,
将磷酸加强热时可发生分子之间脱水生成焦磷酸(H4P2O7),三磷酸以至高聚磷酸:
(1)焦磷酸的结构式是:
(2)高聚磷酸中P原子数为20时,其化学式为:
(3)用n表示高聚磷酸中的磷原子数,高聚磷酸的结构 简式为:
。
23.(10分)氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是 (填序号)。
A,制汽轮机叶片 D.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)写出氮的原子结构示意图 ,根据元素周期律知识,写出氮化硅的化学式
。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不跟其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式 。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅.原应的化学方程式为
。
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com