
8.室温下,在pH=12的某溶液中,由水电离的[0H一]为 ( )
A.1.0×10-7mol·L-1 B.1.0×10-6mol·L-1
C.1.0×10-2mol·L-1 D.1.0×10-12mol·L-1
7.将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量 NaOH溶液后,pH都升高了l,则加入的水与NaOH溶液的体积比为
A.9 B.10 C.11 D.12
6.有①、②、③三瓶体积相等,浓度都是lmol·L-1的HCl溶液,将①加热蒸发至体积减少一半,在②中加入少量CH3COONa固体(加入后溶液仍呈强酸性)③不作改变,然后以酚酞作指示剂,用NaOH溶液滴定上述三种溶液,所消耗的NaOH的溶液体积是 ( )
A.①=③>② B.③>②>① C.③=②>① D.①=②=③
5.将20mL0.4mol·L-1硝酸铵溶液跟50mL0.1mol·L-1氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是 ( )
A.[NO3- ]>[OH一 ]>[NH4+]>[Ba2+] B.[NO3- ]>[Ba2+]>[OH一 ]>[NH4+]
C.[Ba2+]>[ NO3-]>[OH一 ]>[ NH4+] D.[NO3- ]>[ Ba2+]>[ NH4+]>[OH一 ]
4.用水稀释O.1mol·L-1氨水时,溶液中随着水量的增加而减小的是 ( )
A.[OH- ]/[NH3·H20] B.[NH3·H20]/[OH一 ]
C.[H+]和[OH一 ]的乘积 D.OH-的物质的量
3.下列物质的水溶液能导电,但属于非电解质的是 ( )
A.CH3CH2COOH B.Cl2 C.NH4HCO3 D.SO2
2.从下列现象可以判断某酸是强酸的是 ( )
A.加热该酸至沸腾也不分解 B.该酸可以分解石灰石放出CO2
C.该酸可以把Al(OH)3沉淀溶解 D.该酸浓度为O.1mol·L-时的pH为l
1.下列过程需要通电才可进行的是:①电离;②电解;③电镀:④电泳;⑤电化腐蚀。 ( )
A.①②③ B.②③④ C.②④⑤ D.全部
1. (广东省六校2009届高三第二次联考试卷)(12分)在现代生活中,人们越来越注意微量元素的摄入。碘元素对人体健康有着至关重要的作用。为预防碘缺乏病,我国卫生部规定每千克食盐中应含有40~50 mg KIO3。下表是某超市出售的加碘精制盐的有关说明:
|
产 品 标 准 号 |
GB5461-2000 |
|
配 料 表 |
氯化钠、碘酸钾、抗结剂 |
|
氯化钠含量 |
≥98.5% |
|
含 碘 量(以I计) |
20-50mg/kg |
|
储 藏 方 法 |
密闭、避光、防潮 |
|
食 用 方 法 |
待食品熟后加入 |
|
包装日期 |
见打印批号 |
某同学设计实验验证此食盐中是否含碘和检查该食盐是否为合格产品。
(1)完成下列实验报告:
|
实验步骤 |
实验现象 |
实验结论(步骤2用离子方程式表示) |
|
1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡。 |
固体完全溶解 |
食盐及碘酸钾都能溶于水 |
|
2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡。 |
溶液出现棕黄色 |
|
|
3.再向上述溶液中滴加淀粉溶液,振荡。 |
溶液变成蓝色 |
|
(2)加碘食盐的包装袋上标有食用方法:待食品熟后加入。其原因是:
(3)该同学取该食盐样品100.0 g完全溶解于水中,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,则反应的离子方程式为
。为进一步确证样品是否为合格产品,该同学又用0.010 mol·L-1的Na2S2O3溶液滴定,当用去12.00 mL时蓝色刚好褪去(反应方程式为I2+2S2O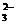 = 2I-+S4O
= 2I-+S4O ),通过计算该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为
(填“合格”或“不合格”)产品。
),通过计算该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为
(填“合格”或“不合格”)产品。
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液。总反应方程式为KI+3H2O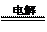 KIO3+3H2↑,则阳极的电极反应式为
;阴极附近pH值 (填“增大”、“减小”、“不变”)。
KIO3+3H2↑,则阳极的电极反应式为
;阴极附近pH值 (填“增大”、“减小”、“不变”)。
2.弱电解质溶液中粒子浓度关系:
如在0.1mol/L的氢硫酸溶液中,根据H2S的分步电离,得各离子浓度大小关系:
c(H+)>c(HS-)>c(S2-)>c(OH-),根据阴阳离子的电荷守恒关系:
c(H+)=2 c(S2-)+ c(HS-)+ c(OH-)。
根据物料守恒关系,得0.1mol/L=c(H2S)+ c(S2-)+ c(HS-)
试题枚举
[例1](2006高考全国Ⅰ,11)11.在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+对于该平衡,下列叙述正确的是
CH3COO-+H+对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
解析:弱电解质的电离平衡 (1)在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态,这叫做电离平衡。(2)影响电离平衡的条件:①温度:升高温度,电离平衡向电离方向移动(因为弱电解质的电离过程是吸热的)。②浓度:当弱电解质溶液被稀释时平衡向电离的方向移动。A、加水,有利于弱电解质的电离,虽离子浓度减小,但离子数目增加B、加碱于弱酸电离的H+反应使电离正向移动,但H+浓度减小。C、加强酸提供H+,抑制弱酸电离,但H+浓度增大,溶液酸性增强.D、加同阴离子的强电解质,同离子抑制弱酸电离,平衡逆向移动。
答案:B
[例2]下列物质的水溶液能导电,但属于非电解质的是
A. CH3COOH B. Cl2 C. NH4NO3 D. SO2
解析:本题考查电解质和非电解质基本概念,因此要正确理解概念的含义并能够加以区别切记不能混淆这些概念。Cl2及溶液既不是电解质,又不是非电解质,因为Cl2不是化合物其水溶液又是混合物。SO2水溶液能导电但不是自身电离出自由移动的离子导电,所以也不是电解质因此是非电解质。
答案:B
[例3](2004年高考全国卷Ⅱ)将0.5mol/LCH3OOH 溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减少 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
解析:常温下,c(H+)·c(OH-)=KW,加水稀释,c(H+)减少,c(OH-) 增大,据电离平衡移动原理,醋酸的电离平衡向右移动。
答案:D
[例4]一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )①NaOH固体 ②KNO3溶液 ③水 ④CH3COONa固体
A.①③ B.②④ C.②③ D.③④
解析:此题主要考离子浓度大小变化以及量的变化之间的判断判断。此类题目要抓住反应后变化和速率影响的因素结合考虑,对基础知识要求能熟练应用。盐酸一定,铁粉过量产生H2的总量取决于盐酸的多少,为减缓反应且不影响H2的产量,应从降低c(H+)入手。
答案:D
[例5]下列电离方程式正确的是( )
A.NaHSO4 Na++H++SO42一
B.NaHCO3
Na++H++SO42一
B.NaHCO3 Na++
HCO3一
Na++
HCO3一
C.H3PO4 3H++PO43-
D.HF+H2O
3H++PO43-
D.HF+H2O F-+H3O+
F-+H3O+
解析:本题考查强弱电解质电离方程式的书写形式及强弱电解质的识别。此题一般单独出现在高考题中可能性不大,但是作为训练题值得大家去思考,特别第四个答案中的水合氢离子容易被同学忽略。
答案:D
[点评]
[例6](2004年广东高考)甲酸和乙酸都是弱酸,当它们的浓度均为0.10 mol/L时,甲酸中的c(H+)约为乙酸中的c(H+)的3倍。现有两种浓度不等的甲酸溶液a和b,以及0.10mol/L的乙酸,经测定它们的pH从大到小依次为a、乙酸、b。由此可知 ( )
A.a的浓度必小于乙酸的浓度 B.a的浓度必大于乙酸的浓度
C.b的浓度必小于乙酸的浓度 D.b的浓度必大于乙酸的浓度
解析:由同浓度的甲、乙两酸,甲酸中的c(H+)大于乙酸中的c(H+),说明甲酸的酸性强于乙酸,由pH:a>乙酸>b知c(H+):a<乙酸<b,a的浓度一定小于乙酸的浓度,b的浓度与乙酸的浓度关系不能确定,可能大于也可能小于,也可以等于。
答案:A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com