
4.已知椭圆 的焦点在y轴上,
的焦点在y轴上,
则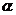 的取值范围是( )
的取值范围是( )
A.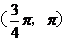 B.
B.  C.
C.  D.
D. 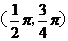
3.等比数列{an}的公比为 ,前n项的和为Sn,
,前n项的和为Sn,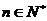 如S2
, S4 –S2
,S6 –S4
如S2
, S4 –S2
,S6 –S4
成等比数列,则其公比为( )
A.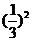 B.
B. 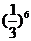 C.
C.  D
D 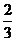
2.在三角形ABC中,根据下列条件解三角形,其中有一个解的是( )
A.b=7,c=3,C=300
B. b=5,c= 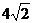 ,B=450
,B=450
C. a=6,b= 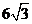 ,B=600
D. a=20,b=30,A=300
,B=600
D. a=20,b=30,A=300
1.在等差数列{an}中,a1 =8,a5 =2,若在每相邻两项间各插入一个数,使之成等差数列,那么新的等差数列的公差( )
A. 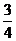 B
B 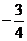 C
C
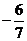 D -1
D -1
6.用电子式表示化合物的形成过程。如HCl的形成过程:
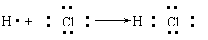
[例3] (2008·山东)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: ;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2 :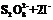
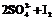
通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。____ ____、
______ _____(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
据以上信息回答下列问题:
a.除去Al3+的离子方程式是_________ _____。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为______ _____。
[解析](1)由氧化还原反应概念易知,反应中Cu、O的化合价降低,被还原。(2)从能够吸收SO2和变废为宝的角度出发可用b、c来回收。(3)Fe3+有氧化性,可氧化I-,而改变反应途径;Fe2+有还原性,可被K2S2O8氧化而改变反应途径。(4)Al(OH)3能溶于NaOH溶液,而Fe(OH)3不溶,可加入过量的NaOH溶液除去Al(OH)3 ;利用Fe2+的还原性,能使酸性KMnO4溶液褪色,可用稀硫酸、KMnO4溶液来验证炉渣中含有FeO。
[答案](1)Cu、O (2)b、c
(3)2Fe3++2I- 2Fe2++I2 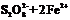
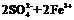
(4)a.Al3+ + 4OH- == AlO2- + 2H2O
b.稀硫酸、KMnO4溶液 ;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
5.电极反应式:表示电极上发生氧化反应或还原反应的式子。要能正确书写原电池的正、负极反应式,总反应式;电解池的阴、阳极反应式,总反应式。详见第36讲。
4.热化学方程式:表明反应放出或吸收热量的化学方程式。书写热化学方程式应注意:
(1)需标明反应物、生成物的聚集状态。
(2)反应系数只表示物质的量,不再表示分子个数,所以可以用分数或倍数。
(3)⊿H表示反应热的数值,无需注明+或-号,但要有单位,且要与反应系数成比例。
(4)需注明测定的温度和压强,若不注明则指的是温度为25℃,压强为101kPa
3.电离方程式:表示电解质在溶液中或熔化状态下发生电离的过程的方程式。要能正确理解强、弱电解质的概念;准确区分强、弱电解质;清楚强、弱电解质的电离方式是不一样的,有完全电离和部分电离之分,有一步电离和多步电离之分,书写时要注意可逆符号。详见第32讲。
2.离子方程式:用实际参加反应的离子的符号来表示离子反应的式子。 要熟练掌握离子方程式的书写规则,书写时要清楚反应物的量对离子方程式的影响。所写出的离子方程式必须要符合客观事实,等式两边要遵守质量守恒和电荷守恒定律,如是氧化还原反应还要遵守电子转移守恒原理……详见第4讲。
1.化学方程式:用化学式来表示化学反应的式子。化学方程式的书写必须要尊重事实,要配平(即要遵守质量守恒定律),还要注明反应发生的条件,有气体生成须注“↑”,溶液中有沉淀生成则须注“↓”。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com