
14.某实验小组学生用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热.下列说法正确的是 ( )
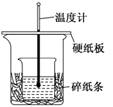
A.如图条件下实验过程中没有热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的作用是固定小烧杯
D.若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,从理论上说所求反应热相等
解析:图中小烧杯与大烧杯之间有很大空隙未填满碎纸条,会有较多的热量散失,A错误;烧杯间碎纸条的主要作用是隔热保温,C错误;D项中所求中和热相同,但反应物的物质的量不同,所以反应热不同,D错误.
答案:B
13.(2009·南通九校联考)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
|
化学键 |
H-H |
Cl-Cl |
H-Cl |
|
生成1 mol化学键时放出的能量 |
436 kJ/mol |
243 kJ/mol |
431 kJ/mol |
则下列热化学方程式不正确的是 ( )
A.H2(g)+Cl2(g)===HCl(g)ΔH=-91.5 kJ/mol
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ/mol
C.H2(g)+Cl2(g)===HCl(g)ΔH=+91.5 kJ/mol
D.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ/mol
解析:由反应热与键能的关系:ΔH=反应物键能总和-生成物键能总和,计算反应A的反应热,ΔH=×436 kJ/mol+×243 kJ/mol-431 kJ/mol=-91.5 kJ/mol,A正确,并由此推知B、D正确,C错误.
答案:C
12.将V1 mL 1.00 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL).下列叙述正确的是 ( )
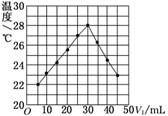
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.0 mol/L
D.该实验表明有水生成的反应都是放热反应
解析:中和反应为放热反应,B正确;分析表中数据,当加入盐酸5 mL、NaOH溶液45 mL时,反应后温度为22℃,故实验时环境温度低于22℃,A错误;加入HCl溶液30 mL时反应放热最多,此时酸碱正好完全中和,c(NaOH)=1.0 mol/L×30 mL÷20 mL=1.5 mol/L,C错误;有水生成的反应不一定是放热反应,如H2+CuO△,H2O+Cu是吸热反应,D错误.
答案:B
11.(2010·东北师大附中高三摸底)2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为2221.5 kJ/mol;正丁烷的燃烧热为2878 kJ/mol;异丁烷的燃烧热为2869.6 kJ/mol;下列有关说法正确的是 ( )
A.丙烷燃烧的热化学方程式为:C3H8(g)+5O2(g)===3CO2(g)+
4H2O(g)
ΔH=-2221.5 kJ/mol
B.相同质量的正丁烷和异丁烷分别完全燃烧,前者需要的氧气多,产生的热量也多
C.正丁烷比异丁烷稳定
D.奥运火炬燃烧时主要是将化学能转变为热能和光能
解析:A项中,水为气态,不正确;正丁烷和异丁烷互为同分异构体,等质量燃烧时需要氧气的量相同.根据正丁烷和异丁烷的燃烧热可推知,C4H10(正)===C4H10(异) ΔH=-8.4 kJ/mol,因此,异丁烷比正丁烷稳定.
答案:D
10.已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)
ΔH=-24.8 kJ/mol
Fe2O3(s)+CO(g)===Fe3O4(s)+CO2(g)
ΔH=-15.73 kJ/mol
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)
ΔH=+640.4 kJ/mol
则14 g CO气体还原足量FeO固体得到Fe单质和CO2气体时对应的ΔH约为( )
A.-218 kJ/mol B.-109 kJ/mol
C.+218 kJ/mol D.+109 kJ/mol
解析:该问题可以转化为CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=?所以应用盖斯定律,若把已知给出的3个热化学方程式按照顺序编号为①、②、③,那么[(①-②)×-③]×即可.
 答案:B
答案:B
6.02×1023
解析:A错,燃烧热的单位应是kJ/mol.B项,图中没有标注物质的系数.C项,由CO2(s)===CO2(g) ΔH>0及盖斯定律可知C项正确.D项,当反应放出509 kJ热量时,参加反应的CO为1 mol,电子转移数为2×6.02×1023.
答案:C
9.(2009·天津高考)已知:2CO(g)+O2(g)===2CO2(g)ΔH=-566 kJ/mol
Na2O2(s)+CO2(g)===Na2CO3(s)+O2(g)ΔH=-226 kJ/mol
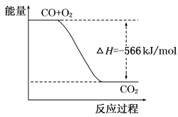 根据以上热化学方程式判断,下列说法正确的是
( )
根据以上热化学方程式判断,下列说法正确的是
( )
A.CO的燃烧热为283 kJ
B.右图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452
kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为
8.有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现如图转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为 ( )
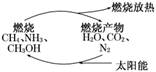
A.化学能 B.热能
C.生物能 D.电能
解析:关键信息是CO2、H2O、N2利用太阳能使它们重新组合,根据图示可知组合成可燃物,而可燃物燃烧后转化为产物并放出热量,产物又结合太阳能转化为燃料,如此循环可知太阳能最终转化为热能.
答案:B
7.已知25℃、101 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s)ΔH=-2834.9 kJ/mol
4Al(s)+2O3(g)===2Al2O3(s)ΔH=-3119.1 kJ/mol
由此得出的正确结论是 ( )
A.等质量的O2比O3能量低,由O2变O3为放热反应
B.等质量的O2比O3能量高,由O2变O3为吸热反应
C.O3比O2稳定,由O2变O3为放热反应
D.O2比O3稳定,由O2变O3为吸热反应
解析:上式减下式得3O2(g)===2O3(g) ΔH=284.2 kJ/mol,可知,同为6 mol 氧原子,O3的能量高于O2,则O3不稳定,由O2变为O3是吸热反应.
答案:D
6.下列说法正确的是 ( )
A.1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热
解析:中和热是在稀溶液里强酸与强碱发生中和反应生成1 mol水时所释放出的热量,而1 mol H2SO4和1 mol Ba(OH)2完全中和时生成2 mol H2O,而且有BaSO4生成,A错误;燃烧热指在25℃、101 kPa时1 mol该物质完全燃烧生成稳定的化合物时,所放出的热量,与实际燃烧的硫的物质的量无关,B正确;CO燃烧的反应是放热反应,C错误;燃烧热与温度和压强有关,不同温度下测得的反应热是不同的,故未指明温度谈燃烧热无意义,且若碳不完全燃烧所放出的热量也不能称为燃烧热,D错误.
答案:B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com