
2.聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程如下图,下列有关说法中错误的是D

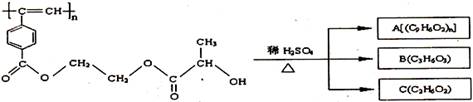
 A.M与A均能使酸性高锰酸钾溶液和溴水褪色
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
 B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
 C.
C. 与热的烧碱溶液反应,可消耗
与热的烧碱溶液反应,可消耗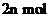 的
的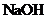
D.A、B、C各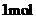 分别与金属钠反应,放出的气体的物质的量之比为1:2:2
分别与金属钠反应,放出的气体的物质的量之比为1:2:2
1. 关于下列图示的说法中正确的是 ( C )
关于下列图示的说法中正确的是 ( C )

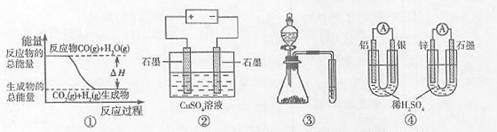






 A.图①表示可逆反应:“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
A.图①表示可逆反应:“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0

 B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
 C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
 D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的最也相同
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的最也相同
[例1] 物质在反应中可表现氧化性、还原性、酸性、碱性等,下面反应的划线物质中,能在同一反应中同时表现上述两种或两种以上性质的有 ( )
①3FeO+10HNO3==3Fe(NO3)3+NO↑+5H2O ②C+2H2SO4(浓)==CO2↑+2SO2↑+2H2O
③8NH3+3Cl2==6NH4Cl+N2 ④NaH+H2O==NaOH+H2↑
⑤2Na2O2+2H2O==4NaOH+O2↑
A.仅有①② B.仅有①③④⑤ C.仅有①③⑤ D.全部
[例2] 对反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法不正确的是( )
A.氧化剂只有CuSO4 B.FeS2既是氧化剂又是还原剂
C.被氧化与被还原的FeS2质量比为3∶7 D.Cu2S是还原剂
[例3] 在过氧化物中加入乙醚后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现蓝色,这是由于生成的过氧化铬(CrO5)溶于乙醚之故。CrO5的结构式如图所示。
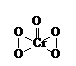 ⑴在CrO5中氧元素的化合价为
。
⑴在CrO5中氧元素的化合价为
。
⑵写出这一反应的离子方程式 。
⑶这个反应 (填“是”或“不是”)氧化还原反应,其理由是 。
[例4] 今有下列三个氧化还原反应:(i) 2FeCl3+2KI=2KCl+2FeCl2+I2 (ii)2FeCl2+Cl2==2FeCl3 (iii)2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O。若某溶液中有Fe2+、I-和Cl-共存,要除去I-而不影响Fe2+和Cl-,可加入的试剂是 ( )
A.Cl2 B. KMnO4 C.FeCl3 D.HCl
[例5] 一定条件下硝酸铵受热分解的反应如下:NH4NO3→HNO3+N2+H2O (未配平)在反应中,被氧化和被还原的氮原子数之比为
[例6] 将M mol的Cu2S跟足量的稀HNO3反应,生成Cu(NO3)2、H2SO4、NO和H2O,则参加反应的硝酸中被还原的硝酸的物质的量是 ( )
A. 4M mol B.10M mol C.10M/3 mol D.2M/3 mol
[例7] SnO2与碳酸钠和S共熔可转变为可溶性盐,反应方程式为:SnO2+2Na2CO3+4S高温====Na2SnS3(硫代锡酸钠)+Na2SO4+2CO2↑。下列说法正确的是 ( )
A.高温条件下SnO2的氧化性强于S B.Na2SnS3既是氧化产物又是还原产物
C.生成1mol Na2SnS3时转移6mol电子 D.还原剂与氧化剂的质量比为3∶1
[例8] 对一定量的KClO3加热使其部分分解,然后向反应后的混合物中加入足量硫酸并加热发生如下反应:KClO3+5KCl+3H2SO4=3Cl2↑+3K2SO4+3H2O 。假设原KClO3为m mol,第一步反应KClO3分解率为a,两步反应生成的O2与Cl2总物质的量为n mol。
(1)计算当氯元素全部转化为Cl2时的a值 及n与m的函数关系式
(2)讨论在a取不同值时,n与a、m的函数关系式及n的最大值。
[例9] 配平
(1) __HClO3 +__P4 +__H2O = __HCl +__H3PO4
(2) __HClO2= __ClO2 +__Cl2 +__H2O
(3) __Fe3O4 + __MnO4- +_H+ = __Fe3+ +__Mn2+ +__H2O
(4) __P +__KOH +__ H2O = ___KH2PO4 +___PH3
(5) __Pt +__HNO3 +__HCl =__H2PtCl5 +__NO↑+__( )
(6) __KMnO4 +__H2C2O4 +__( ) = __CO2 +__K2SO4 +__MnSO4 +__( )
(7) __Cl2 +__As2S3 +__H2O = __HCl +__H3AsO4 +__H2SO4
[例10] 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:
NO3-+4H++3e- → NO+2 H2O
在下列四种物质KMnO4、Na2CO3、KI、Fe2(SO4)3中的一种物质(甲)中滴加少量稀硝酸能使上述还原过程发生。
⑴写出并配平该氧化还原反应的方程式:
⑵反应中硝酸体现的性质是: 、 。
⑶反应生成0.3mol H2O,则转移电子的物质的量是 mol。
⑷若反应后还生成KIO3,且其它物质保持不变,则反应中氧化剂与还原剂的物质的量之比将 (填“增大”、“减小”、“不变”或“不能确定”)。
[例11] 某一反应混合物中有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称是叠氮化铅,其中铅为+2价,N平均为-1/3价)六种物质,已知Pb(N3)2是反应物之一,根据你学过的有关化学知识和定律,回答下列问题:
⑴铅的常见价态是 ,可将Pb3O4写成常见化合价的氧化物的形式为 。
⑵已知Cr的常见化合价为+2、+3、+6,Mn的常见化合价为+2、+4、+6、+7,则Cr(MnO4)2中Cr的化合价为 ,Mn的化合价为 。
⑶Pb(N3)2在该反应中是 剂,氧化产物是 ,1molPb(N3)2参加反应,转移电子数是 mol。
⑷试写出并配平该反应方程式 。
(三)、根据新信息、新材料,以陌生材料为背景写化学方程式,考查方程式的书写及信息转化能力
智利硝矿石中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。写出该反应方程式,并用单线桥标明电子转移方向和数目:
(二)、氧化还原反应方程式的配平
化合价升降法配平氧化还原反应方程式的方法步骤:______________________
__ _
常见类型及配平技巧如下:
(1)简单类型:分子间两种不同元素得失电子和同种元素的歧化反应或归中反应.例
___K2Cr2O7 +____HCl(浓) ==____KCl+____CrCl3 +____Cl2↑ +____H2O
____Cl2 +____NaOH ==____NaCl +____NaClO3 +____H2O

 (2) 三种元素变价的反应类型。 例:
(2) 三种元素变价的反应类型。 例:
__Cu2S +__HNO3 ==__Cu(NO3)2 +__H2SO4 +__NO+__H2O
主要技巧: 对既有得电子又有失电子的物质,作整个分子得失电子代数和的计算。本例Cu2S共失10e-。
(3) 含元素价态难确定物质的反应。 (零价配平法)如
__Fe3C +__HNO3== __Fe(NO3)3 +__CO2 +__NO +__H2O
(4) 有机物的氧化还原反应
有机物被氧化或还原时,通常是碳元素变价。当有机物化学式较简单时,可与无机物一样计算碳原子的价态变化;当有机物化学式较复杂时,(以结构式出现时,先改写成化学式)适宜计算分子中所有碳原子总化合价的变化。
如C6H5CHO→C6H5COOH,反应前碳元素7个原子总化合价为-4价,反应后为-2价,共升高2价。
(5) 缺项配平,(缺项,即化学方程式中尚有某些分子式空缺)。
缺项一般是非氧化还原的物质,最常见为酸、碱或水。可先观察,初步确定所缺物质,然后配平;也可以先不理会缺项,进行一般步骤的配平,最后观察确定缺项所含元素,并进一步确定其化学式。两种方法应视具体情况灵活应用。
__Ag3AsO4+__Zn+__( )= __Ag↓+__ZnSO4+__AsH3↑+__H2O
(6)整体法配平
___Na2Sx+_______NaClO+_______NaOH=______Na2SO4+_____NaCl+___H2O
(一)、氧化还原反应的基本概念
1.氧化还原反应中物质及变化关系:(完成表格)
|
反应物 |
表现性质 |
发生的变化 |
化合价的变化 |
生成物 |
|
氧化剂 |
|
|
|
产物 |
|
还原剂 |
|
|
|
产物 |
常见的氧化剂
常见的还原剂
表达氧化还原关系的常用形式有 “双线桥”式和 “单线桥”式
|
形式 |
示例 |
箭头意义及指向 |
|
双线桥式 |
2Na2S+Na2SO3+3H2SO4==3S↓+3Na2SO4+3H2O |
|
|
单线桥式 |
2Na2S+Na2SO3+3H2SO4==3S↓+3Na2SO4+3H2O |
|
2、氧化性、还原性的比较
元素处于最高价、最低价和中间价态时的性质特点:
化合价 时表现氧化性,化合价 时表现还原性(填“降低”或“升高”)。
氧化性、还原性强弱的比较途径:
(1)根据一个已知的氧化还原反应判断(电解反应除外)
氧化性: 氧化剂 氧化产物 (强于或弱于)
还原性: 还原剂 还原产物
(2) 根据可变价金属被氧化的程度判断:
例:氯气和硫跟铁反应时,产物中铁的化合价分别为 可见Cl2的氧化性比S 。
(3)根据反应条件(即难易程度)判断:
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2+8H2O (不需要特别条件)
MnO2+4HCl=MnCl2+Cl2+2H2O (加热)
O2+4HCl=2Cl2+2H2O (加热、加压、催化剂)
比较KMnO4、O2、MnO2的氧化性强弱:
(4)根据金属活动性顺序比较(注意Fe的价态):
位置靠前的金属,单质 性较强,其离子的 性较
(5)根据元素所在周期表位置关系判断: 同主族从上到下,或同周期从左到右,其单质的性质递变和离子的性质递变规律:
(6)根据原电池和电解池电极的极别或发生的反应判断:
原电池两金属电极,被腐蚀的一极是 极,该金属 性较强;冒气体(H2)或质量增加的极是 极,该金属 性较弱;电解反应中,阴极上先反应的阳离子 性较强,阳极上先反应的阴离子 性较强。
注意:氧化性还原性的强弱只与原子得失电子的 有关,而与得失电子的多少无关
3、基本规律:
⑴、先后规律:一种氧化剂氧化两种还原剂或一种还原剂还原两种氧化剂时有先后顺序。其规则是: “强者”先反应.
⑵、强弱规律:同一氧化还原反应中,氧化剂的氧化性强于氧化产物;还原剂的还原性强于还原产物。
⑶、归中规律:同种元素不同价态间得失电子的 “归中反应”(如表中示例),电子转移方向遵循 “归中不交叉”的规则。
⑷、守恒规律:氧化还原反应中,得失电子总数守恒,化合价升降总数守恒(用于计算)
4.有关氧化还原反应的计算
有关氧化还原反应的计算常常应用的关系有 “电子得失守恒” “电荷数守恒”等.
2、高考试题常以各种知识材料为背景,要求考生判断氧化还原反应中电子转移的方向和数目,能书写、配平反应方程式、应用守恒观点进行计算及信息转化能力。
1、氧化还原反应是高中教学的重点、难点,也是高考的热点,且常考常新,涉及选择、推断及计算。有关氧化还原的考查形式和内容不断发生变化,但其仍然存在着一定的规律。就是要理解氧化还原反应,了解氧化剂和还原剂的概念;能比较物质的氧化(还原)性强弱并应用到具体问题中。
13.(1)C4H8
 (2)
(2)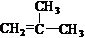
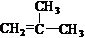
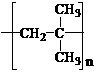
12.(1) (2) 加成反应 水解反应(或取代反应)
(2) 加成反应 水解反应(或取代反应)
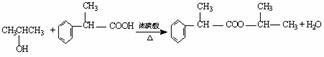
(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com