
24.(9分)(1)盖斯定律的重要用途之一就是间接计算有些反应的反应热.
1 mol气态钠离子和1 mol气态氯离子结合生成1 mol氯化钠晶体所释放的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示氯化钠晶体的晶格能的是 。
A.Na+(g)+Cl-(g)=NaCl(s) △H B.Na(s)+1/2Cl2(g)=NaCl(s) △H1
C.Na(s)=Na(g) △H2 D.Na(g)-e-=Na+(g) △H3
E.1/2Cl2(g)=Cl(g) △H4 F.Cl(g)+e-=Cl-(g) △H5
②写出△H1 与 △H、△H2、△H3、△H4、△H5 之间的关系式:
。
(2)在一定条件发生反应:2KClO3+I2==2KIO3+Cl2↑,它属于 (从化合反应、分解反应、置换反应、复分解反应中选择)。有人据此认为碘的非金属性比氯强,你认为对吗?理由是
。
23.(4分)在101 kPa时,1 mol CH4 完全燃烧生成CO2和液态H2O, 放出890.3 kJ的热量,CH4的燃烧热为 。1000 L CH4(标准状况)燃烧后所产生的热量为 。
22.(13分)如图所示,25℃时,在烧杯A中装有50.00 ml蒸馏水,烧杯B 中盛有50.00 ml 0.5mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通,把C烧瓶放入A烧杯中,D烧瓶放入B烧杯中。向 A烧杯中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 2g 苛性钠固体,小心搅拌也使其迅速溶解。
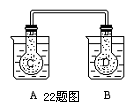
回答下列问题:
(1)烧杯A中温度(填“升高”、“降低”或“不变”,下同) ;烧杯B中温度 。
(2)已知在NO2生成N2O4的可逆反应中,正反应是放热反应,逆反应是吸热反应:
2 NO2(g) N2O4(g)。从上面实验可知C烧瓶中混合气体颜色(填“变浅”、“变深”或“不变”,下同) ;D烧瓶中混合气体颜色
。
N2O4(g)。从上面实验可知C烧瓶中混合气体颜色(填“变浅”、“变深”或“不变”,下同) ;D烧瓶中混合气体颜色
。
(3)若实验测得B烧杯中酸碱中和反应放热1.4325kJ,则NaOH溶液和HCl溶液发生中和反应的热化学方程式为 。
(4)若起始时在D烧瓶中充入mg N2O4,此时测得烧瓶中压强为101kPa,当可逆反应N2O4(g)  2 NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为
(精确到小数点后两位)。
2 NO2(g)达到化学平衡状态时压强变为1.515×105Pa,则平衡混合气体的平均相对分子质量为
(精确到小数点后两位)。
21.(8分)在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
|
t |
K |
|
700 |
0.6 |
|
800 |
0.9 |
|
830 |
1.0 |
|
1000 |
1.7 |
|
1200 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= 。
(2)该反应为 反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是 。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为 ℃。
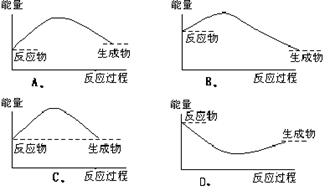
20.下列各图中表示正反应是吸热反应的图是 ( )
第Ⅱ卷(非选择题,共50分)
19.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如右图,下列描述正确的是( )
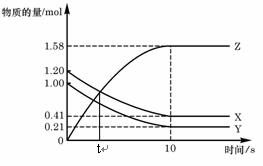
A.t秒时该反应达到化学平衡状态
B.反应开始到10 s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) +
Y(g) 2Z(g)
2Z(g)
18.某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
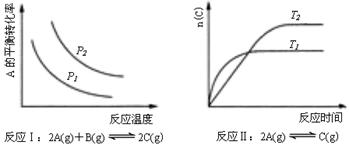
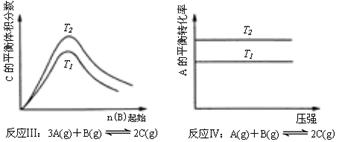
根据以上规律判断,下列结论正确的是( )
A.反应Ⅰ:△H>0,P2>P1
B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H﹤0,T2>T1
D.反应Ⅳ:△H<0,T2>T1
17.已知450℃时,反应H2(g)+I2(g) 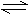 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) 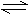 H2(g)+I2(g)的化学平衡常数为(
)
H2(g)+I2(g)的化学平衡常数为(
)
A.50 B.0.02 C.100 D.无法确定
16.在一密闭容器中,反应aA(g)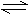 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.物质A的转化率小了 B.平衡向正反应方向移动了
C.物质B的质量分数减小了 D.b>a
15.一定条件下,可逆反应N2 +3H2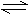 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是(
)
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是(
)
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数小于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com