
2.将铜丝在Cl2中燃烧后再加入适量水,整个
过程中观察到的现象是 ( )
A.产生白色的烟 B.产生棕色的烟
C.生成棕色溶液 D.生成蓝绿色溶液
(本题考查铜丝在Cl2中反应的实验现象,要理解并熟记!)
1.特大洪水过后,受灾地区的水源常被严重污染,下列物质中能对被污染的饮用水起消毒杀菌作用的是
( )
A.生石灰 B.明矾
C.绿矾 D.漂白粉
(本题考查相关物质的用途,从物质的性质去理解并熟记用途。)
4.(2000年上海高考题)KClO3和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯。其变化可个表述为:



 KClO3+ HCl(浓)→ KCl+ ClO2↑
KClO3+ HCl(浓)→ KCl+ ClO2↑


 + Cl2↑+
+ Cl2↑+
(1)请完成该化学方程式并配平(未知物化学式和系数填入框内)。
(2)浓盐酸在反应中显示出来的性质是_______(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)产生0.1molCl2,则转移的电子的物质的量是_________mol。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的_______倍。
(本题考查氧化还原反应的概念、规律、电子转移的数目、方程式的配平等,要熟练掌握基本概念和化合价升降配平法,最后计算时要注意括号内的说明。)
新活题网站
3.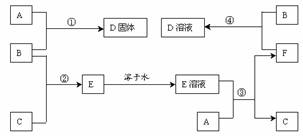 (2001年广东、河南高考题)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答;
(2001年广东、河南高考题)室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下面框图进行反应。又知E溶液是无色的,请回答;
(1)A是 、B是 、C是________(请填化学式)。
(2)反应①的化学方程式为:
(3)反应③的化学方程式为:
(4)反应④的化学方程式为:
(本题是无机框图推断题,寻找题眼,大胆假设,仔细验证。)
2.(2001年广东、河南高考题)甲、乙、丙、丁分别是盐酸、碳酸钠、氯化钙、硝酸银4种溶液中的一种。将它们两两混合后,观察到的现象是:①甲与乙或丙混合都产生沉淀;②丙与乙或丁混合也产生沉淀;③丁与乙混合产生无色气体。回答下面问题:
(1)写出丁与乙反应的离子方程式:
。
(2)这四种溶液分别是甲:_________、乙:_________、丙:_________、丁:_________。
(本题考查常见重要离子之间的反应,找出突破口是关键。)
1.(1996年上海高考题)检验氯化氢气体中是否混有Cl2,可采用的方法是 ( )
A. 用干燥的蓝色石蕊试纸
B. 用干燥有色布条
C. 将气体通入硝酸银溶液
D. 用湿润的淀粉碘化钾试纸
(本题考查HCl、Cl2的鉴别,要注意它们的共性、个性,利用个性差异来解题。)
5.氯离子用酸化的AgNO3(aq)来检验,现象是产生白色沉淀。
典型题点击
4.氯气用于消毒、制造盐酸和漂白粉以及有机溶剂、农药等。
3.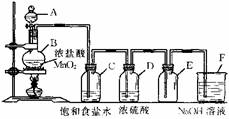 在实验室用MnO2与浓盐酸反应制氯气,反应装置如下:
在实验室用MnO2与浓盐酸反应制氯气,反应装置如下:
工业上由氯碱工业得到。
2.氯原子最外层7个电子,易得到1个电子,形成8电子稳定结构,两个氯原子通过一对共用电子对(非极性键)形成氯气(非极性分子)。氯气很活泼具有很强的氧化性。(1)与绝大多数金属(在点燃或灼烧的条件下)直接反应,生成高价氯化物。红热的Cu丝在Cl2中燃烧产生棕色的烟,溶于少量水后得蓝氯色的CuCl2(aq);红热的Fe丝在Cl2中燃烧产生棕黄色的烟,溶于水后得黄色的FeCl3(aq)。(2)与H2、P等非金属反应,纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,生成的HCl在空气中呈雾状,而H2与Cl2在光照条件下则发生爆炸;P与不足量Cl2反应生成PCl3,而与足量Cl2则生成PCl5。(3)与水反应,氯气溶于水得“氯水”,呈黄绿色,部分Cl2与水反应。新制氯水存在七种粒子(三分子四离子),而久置氯水则变成稀盐酸。次氯酸有弱酸性、强氧化性、不稳定性、漂白性等四性。(4)与碱反应,生成金属氯化物、次氯酸盐、水。与NaOH(aq)反应实验室用于吸收多余氯气。与Ca(OH)2(石灰乳)作用制漂白粉、漂粉精,其有效成分是次氯酸钙,次氯酸钙在潮湿的空气里,漂白效果更好。(5)与低价态物质反应,如SO2、Na2SO3、FeCl2、NaBr、KI、H2S等。(6)与有机物发生加成或取代反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com