
1.C;2.C; 3.B; 4.B、C; 5.C; 6.D; 7.C
讲析:1.臭氧氧化有机色素,不是吸附作用。2.减压蒸馏可防止过氧化氢分解。3.随着核电荷数的递增,元素的非金属性逐渐减弱,而不是增强. 4.由同素异形体的定义进行辨析。5.根据元素周期表的有关知识可知:,116号元素应为第7周期ⅥA族,再由氧族元素的递变性进行分析。6.5种物质全有漂白作用,但原理不全部一样。Cl2、Na2O2、Ca(ClO)2因氧化而漂白,活性炭具有吸附作用而SO2是与有色物质化合。7.A、D选项体现SO2的还原性,B选项是SO2与碱性溶液作用是溶液碱性减弱而褪色。
12.6,故该溶液成分为Na2SO3和NaHSO3。再列方程组求得各自的物质的量。
(3)由上述①、②两个反应可知,当x=1/2时,发生反应①,x=1时,发生反应②,这样将x分成三个段进行讨论,得出结果。
新活题网站
4.(1)153.6Kg;(2)该溶液成份为Na2SO3和NaHSO3 ,NaHSO30.1mol,Na2SO30.05mol;
(3)
|
x |
n(NaHSO3) |
|
x≤1/2 |
0 |
|
1/2<X<1 |
n(NaHSO3)=2n(SO2)-n(NaOH) |
|
x≥1 |
n(NaHSO3)= n(NaOH) |
讲析:(1)由关系式:SO2-CaSO4·2H2O进行计算;
(2)用极值法判断溶液的成分:若溶液中溶质全为Na2SO3,SO2+2NaOH=Na2SO3+H2O①得12.6g,若溶液中溶质
全为NaHSO3,SO2+NaOH=NaHSO3②得20.8g。今20.8>16.7>
3.(1)漂白;(2)还原;(3)PbS+4H2O2=PbSO4+4H2O。
讲析:(1)因H2O2不能与NaOH反应,只能是与酚酞作用,这是它的漂白性,其实质是强氧化性。(2)溶液的紫红色消褪了,说明MnO4-没有了,它被还原了。(3)有题意:PbS变成PbSO4,作还原剂,则H2O2作氧化剂被还原成H2O,写出方程式再配平。
2.(1)SO2+CaO=CaSO3,2CaSO3+O2=2CaSO4;
(2)溶有SO2的品红溶液 ;SO2气体逸出,品红溶液恢复红色。
讲析:(1)煤燃烧过程中产生SO2,与CaO反应生成CaSO3,CaSO3与O2进一步反应,变成CaSO4。
(2)试管中的无色溶液,加热后变为红色,冷却后恢复无色,联想到SO2与品红的漂白实验,此题就很容易了。
1. A
讲析:甲试管通入SO2至饱和后加入足量硝酸,SO2
被氧化成SO42-,进而形成BaSO4沉淀;乙试管通入SO2至饱和后加入足量氢氧化钠溶液,与SO2反应生成SO32-,进而形成BaSO3沉淀。
15.在标准状况下750mL含O3的氧气,其中O3若完
全分解,其体积变为780mL(标准状况)。若将此含有O3的氧气1L,通入适量的KI溶液中,发生如下反应:
2KI+O3+H2O==2KOH+I2+O2。求析出I2的质量是多少克?
14.环境监测测定水中溶解氧的方法是
①量取amL水样迅速加入MnSO4溶液和碱性KI溶液(含有KOH),立即塞好塞子,并振荡摇匀,使之充分反应。
②测定;开塞后迅速加入适量硫酸(提供H+)使之生成I2,再用bmol/L的Na2S2O3溶液滴定(和I2反应),消耗了VmL(以淀粉为指示剂)Na2S2O3溶液。
有关的化学方程式为:2Mn2++O2+4OH-==2MnO(OH)2(该反应极快);MnO(OH)2+2I-+4H+== Mn2++ I2+3H2O;
I2+2S2O32-==2I-+ S4O62-。
试回答:
(1)水中溶解氧的量(以g/L为单位)的计算式为:
。
(2)滴定时(I2和S2O32-反应)以淀粉为指示剂,终点时溶液由 色变为 色。
(3)滴定管经水洗和蒸馏水洗涤后,加滴定剂Na2S2O3,
滴定时会导致测定结果 (填“偏高”、“偏低”、或“无影响”)。
(4)若打开塞子加H2SO4时动作缓慢,测定结果将
(填“偏高”、“偏低”、或“无影响”)。
13.过二硫酸钾(K2S2O8)在高于100℃的条件下能发生反应,化学方程式为:
|
2K2S2O8 2K2SO4+SO3↑+O2↑。现称取一定质量的K2S208固体(含有不分解的杂质)进行如下实验:加热使过二硫酸钾完全分解,通过测定氧气的体积计算过二硫酸钾的
纯度,并收集三氧化硫,进行观察和检验。
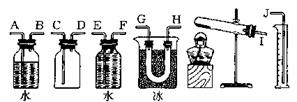
(1)试从图中选用几种必要的装置,连接成一整套实 验装置。所选用装置的接口编号连接顺序是
。
(2)观察到的三氧化硫的颜色和状态是 。 将三氧化硫与水反应,鉴定反应产物中阴离子的方法是
。
(3)若实验时称取过二硫酸钾的质量为Wg,测得氧气的体积(折算成标准状况)为amL,则此过二硫酸钾的纯度为 。
12.(1)将H202溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H202是二元弱酸(H202
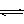 H++HO2-),消耗了OH-,而使红色腿去。乙同学认为H202具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
H++HO2-),消耗了OH-,而使红色腿去。乙同学认为H202具有强氧化性,将酚酞氧化,红色消失。试设计一个实验论证甲、乙两位同学的解释中谁正确。
答:
。
(2)甲同学向品红溶液中通入一种气体后,品红褪色。乙同学设计了一个很简便的实验便知甲同学通的是
Cl2还是SO2。他的实验方案是:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com