
3. 溶液的酸碱性和pH的关系
⑴ pH的计算:pH=-lg c(H+)
⑵ 酸碱性和pH的关系:
室温中性溶液C(H+)=C(OH-)=10-7mol∕L,pH=7
酸性溶液:c(H+)>c(OH-),c(H+)>1×10-7 mol∕L,pH<7
碱性溶液:c(H+)<c(OH-),c(H+)<1×10-7 mol∕L,pH>7
⑶pH的测定方法:①pH试纸;②酸碱指示剂、pH计等。
2. 掌握影响水的电离平衡的因素
⑴酸和碱:酸或碱加入都会电离出H+或OH-,均使水的电离左移,从而抑制水的电离。
⑵温度:若升温,由于水电离吸热,升温将促进水的电离,平衡右移,c(H+)与c(OH-)同时同等程度增加,pH变小,但c(H+)与c(OH-)始终相等,故仍显中性。
⑶能水解的盐:不管水解后溶液呈什么性,促进水的电离,使水的电离程度增大。
⑷其他因素:如向水中加入活泼金属,由于与水电离出的H+直接作用,因而促进了水的电离平衡向电离的方向移动。
1. 理解水的电离和离子积的概念。
 ⑴水的电离平衡:水是极弱的电解质,水的电离方程式 H2O+H2O H3O++OH-(正反应为吸热反应),其电离常数:K= c(H+)·c(OH-)/c(H2O)。
⑴水的电离平衡:水是极弱的电解质,水的电离方程式 H2O+H2O H3O++OH-(正反应为吸热反应),其电离常数:K= c(H+)·c(OH-)/c(H2O)。
⑵水的离子积常数:Kw=c(H+)×c(OH-)例:25℃时水的Kw=10-14,水的离子积常数与温度有关,温度升高,Kw增大。
⑶无论纯水还是酸、碱、盐的稀溶液,水的离子积常数为该温度下的Kw。
20.将0.05mol/L的盐酸溶液和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得混合溶液的c(OH-)=0.01mol/L.用上述氢氧化钠滴定20mLc(H+)=0.001mol/L的某一元弱酸溶液,达到终点消耗12.5mL氢氧化钠溶液.试求:
(1) 氢氧化钠溶液的物质的量浓度
(2) 此一元弱酸的物质的量浓度
19. 弱酸和它们的盐或弱碱和它们的盐组成的混合物的溶液称为缓冲溶液. 缓冲溶液具有抵抗外来少量酸或碱的干扰, 使溶液的 PH 值基本保持不变(缓冲作用), 人们血液中的缓冲作用的缓冲对是 H2CO3 (弱酸)和 HCO3-(弱酸盐),缓冲作用的原理可表示为: HCO3- + H+ = H2CO3
H2CO3 + OH- = HCO3- + H2O
(1) 含有一定量HAc 和 NaAc 的水溶液也具有缓冲作用, 写出在此过程中加入酸或碱的离子反应方程式为:
加入酸_________________________;
加入碱
(2) 请写出另外可以形成缓冲溶液的两组物质:
, 。
18.现有下列各坐标图:
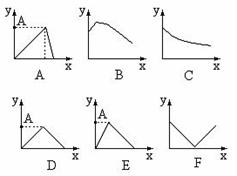
(1)x轴坐标代表加水量,y轴代表[H+],能表示出0.1mol/L醋酸在稀释时的状况的坐标图是 (2)x轴代表向硝酸银溶液中加入氨水的物质的量的多少,y轴代表沉淀量的变化,符合这一情况的坐标图是
(3)x轴代表在搅拌情况下向铝盐溶液中加入NaOH物质的量的多少,y轴代表混和物中沉淀量的变化,那么该坐标图应是
(4)x轴代表向1升0.01mol/L石灰水中通入CO2的质量(克),y轴代表沉淀质量(克)的变化,符合这一情况的坐标图是 ,A点的数值为 克 (5)x轴代表在氢氧化钡溶液中滴加硫酸的量,y轴代表溶液导电性的变化,符合这一关系的坐标图是
17. 已知HCO3-比HBrO更难电离,但HBrO的酸性比H2CO3弱,写出以下反应的离子方程式: (1)向NaHCO3溶液中滴加少量溴水
(2)向Na2CO3溶液中滴加少量溴水
16.重铬酸钾(K2Cr2O7)是橙色晶体,铬酸钾(K2CrO4)是黄色晶体,将重铬酸钾溶于水配成2%的溶液,重铬酸钾发生水解,反应的离子方程式如下:Cr2O72?+H2O=2CrO42-+2H+当达平衡时,溶液颜色介于橙色 和黄色之间。
(1) 滴入10滴2摩/升NaOH溶液于3毫升2%的K2Cr2O7溶液中,现象是___________
_______________,理由__________________________;
(2) 将3滴2摩/升H2SO4溶液加入上述(1)所得溶液中现象是____________________,理由 ____________________________________;
(3)在上述(2)所得溶液中,再滴入5滴2摩/升H2SO4溶液,现象是__________________理由 ____________________________________。
15.已知白色PbSO4难溶于水,也不溶于HNO3,却可溶于醋酸铵饱和溶液中,其反应式为:
PbSO4+CH3COONH4 (CH3COO)2Pb+(NH4)2SO4
(CH3COO)2Pb+(NH4)2SO4
在无色的(CH3COO)2Pb溶液中通入H2S气体,有黑色沉淀(PbS)生成,则下列说法正确的是( )
A.(CH3COO)2Pb是难电离的物质
B.CH3COONH4是弱电解质
C. PbSO4溶于CH3COONH4溶液的离子反应为:
PbSO4+2CH3COO- (CH3COO)2Pb+SO42-
(CH3COO)2Pb+SO42-
D. 通入H2S时离子反应为:Pb2++2CH3COO-+2H2S PbS↓+2CH3COOH
PbS↓+2CH3COOH
14.在等物质的量浓度的两种弱酸的钠盐(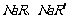 )溶液中分别通入适量的CO2,发生如下反应:
)溶液中分别通入适量的CO2,发生如下反应:
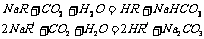

把HR和HR/在水中电离出H+的能力作比较,正确的判断是
A HR较强 B HR/较强
C 两者相同 D 无法比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com