
6.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
B.常温下,1 molO2和O3的混合气体中所含氧原子数为2.5NA
C.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA
D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
5.下列有关物质性质的叙述正确的是
A.浓硫酸能干燥氢气、氯气、一氧化碳等气体,说明浓硫酸具有吸水性
B.SiO2既能溶于NaOH溶液又能溶于HF,说明SiO2是两性氧化物
C.乙炔能使溴水、酸性高锰酸钾溶液褪色,说明乙炔具有漂白性
D.纤维素的水解产物能够发生银镜反应,说明纤维素是一种还原性糖
4.下列有关实验操作的叙述正确的是
A.利用右图所示装置制取并收集氨气
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH
C.用铂丝蘸取某溶液于无色火焰灼烧,火焰呈浅紫色,证明其中含K+
D.在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤分离出苯酚
3.在碘酸钠(NaIO3)的碱性溶液中通入氯气,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法错误的是
A.在该反应中碘酸钠作还原剂
B.碱性条件下,氯气的氧化性强于高碘酸钠
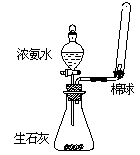 C.反应中生成1 mol Na2H3IO6,转移2 mol电子
C.反应中生成1 mol Na2H3IO6,转移2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2 : 1
2.下列有关化学用语使用正确的是
A.醛基的电子式: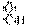 B.原子核内有8个中子的碳原子:
B.原子核内有8个中子的碳原子: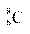
C.钾离子结构示意图: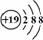 D. 2-甲基-1-丙醇的结构简式:
D. 2-甲基-1-丙醇的结构简式: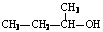
1.温家宝总理在2010年政府工作报告中提出,要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。下列有关做法与此不相符的是
A.大力开发丰富的煤炭资源,减少对石油的依赖
B.回收废弃的饮料包装纸,制作成公园内的休闲长椅
C.在西部和沿海地区兴建风力发电站,解决能源问题
D.鼓励购买小排量汽车,推广电动、混合动力汽车
(2)周期表中______族所含元素最多,______族元素形成化合物最多.
(3)请分析周期数与元素种数的关系,然后预测第八周期最多可能含有的元素种数为______.
(4)居里夫人发现的镭是元素周期表中第七周期的第ⅡA的族元素,下列关于镭的性质的描述中不正确的是______.
A.在化合物中呈+2价 B.氢氧化物呈两性
C.单质使水分解,放出氢气 D.碳酸盐难溶于水
解析:(1)第六、七周期中由于在ⅢB族出现了镧系、锕系,使元素种类比前面周期的要多.也因为如此,第ⅢB族所含元素最多.
(2)已知有机物的种类远远多于无机物,而有机物中含有碳元素,可知ⅣA族元素形成的化合物最多.
(3)根据表可通过分析数据归纳出潜在的规律:
|
周期数 |
一 |
二 |
三 |
四 |
五 |
六 |
七 |
|
元素种数 (最多) |
2 2×1 |
8 2×22 |
8 2×22 |
18 2×32 |
18 2×32 |
32 2×42 |
32 2×42 |
可见规律是2n2(n=1,2,3,……),由此预测第八周期元素种数应为2×52,故答案为50.
(4)在周期表中同族元素,从上到下其金属性依次增强,因此,可以确定其单质使水分解放出氢气;其氢氧化物呈现出比氢氧化钙更强的碱性,而不能呈两性.
答案:(1)第六、七周期中在ⅢB族出现了镧系和锕系
(2)ⅢB ⅣA (3)50 (4)B
14.(11分)下表是元素周期表主族元素的一部分,短周期元素X的最高正价是+5价,Y单质可在空气中燃烧.
|
W |
X |
Y |
|
|
|
Z |
(1)Z的元素符号是________________,原子结构示意图是____________.
(2)W的最高价氧化物不溶于水,但能溶于烧碱溶液,反应的化学方程式为__________________________________________________________.
(3)探寻同一族元素性质的一些共同规律,是学习化学的重要方法之一.在下表中列出对H2ZO3各种不同化学性质的推测,举例并写出相应的化学方程式.
|
编号 |
性质推测 |
化学方程式 |
|
示例 |
氧化性 |
H2ZO3+4HI===Z↓+2I2+3H2O |
|
1 |
|
|
|
2 |
|
|
 解析:X是第ⅤA族元素,Y是第ⅥA族元素,Y能在空气中燃烧,则Y为S,W为Si,X为P,Z为Se.根据同主族元素的性质规律,可知H2SeO3的性质与H2SO3相似.
解析:X是第ⅤA族元素,Y是第ⅥA族元素,Y能在空气中燃烧,则Y为S,W为Si,X为P,Z为Se.根据同主族元素的性质规律,可知H2SeO3的性质与H2SO3相似.
答案:(1)Se
(2)SiO2+2NaOH===Na2SiO3+H2O
(3)
|
编号 |
性质推测 |
化学方程式 |
|
1 |
还原性 |
H2SeO3+Br2+H2O===H2SeO4+2HBr |
|
2 |
酸性 |
H2SeO3+2NaOH===Na2SeO3+2H2O |
(或其他合理答案,如“不稳定性”)
13.(10分)元素周期表中前7个周期完全排满时元素的种数如下表所示:
|
周期数 |
一 |
二 |
三 |
四 |
五 |
六 |
七 |
|
元素种数(最多) |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
11.(14分)下表为元素周期表的一部分,请回答有关问题:
|
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
|
② |
|
|
3 |
|
③ |
④ |
⑤ |
|
⑥ |
⑦ |
⑧ |
|
4 |
⑨ |
|
|
|
|
|
⑩ |
|
(1)⑤和⑧的元素符号是________和________.
(2)表中最活泼的金属是________,非金属性最强的元素是________(填写元素符号).
(3)表中能形成两性氢氧化物的元素是________(填名称),分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:_______________________,
________________________________________________________________________.
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
________________________________________________________________________
________________________________________________________________________.
解析:(1)首先根据位置特点推断出各元素名称(或符号)①为N,②为F,③为Mg,④为Al,⑤为Si,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br.
(2)最活泼金属在左下角,最活泼非金属在右上角.
(3)形成两性氢氧化物的元素为Al,Al(OH)3可分别与KOH和H2SO4反应.
(4)可根据非金属元素间相互置换关系比较Cl2和Br2的氧化性强弱.
答案:(1)Si Ar (2)K F
(3)铝 2Al(OH)3+3H2SO4===Al2(SO4)3+6H2O
Al(OH)3+KOH===KAlO2+2H2O
(4)将⑦单质(Cl2)通入盛有⑩的钠盐(NaBr)溶液中,加入四氯化碳并振荡,看四氯化碳层 是否呈橙色,若呈橙色,则说明Cl2氧化性大于Br212.(15分)(2010·北京海淀模拟)A、B、C为短周期元素,在周期表中所处的位置如右图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
(1)写出A、B、C三种元素的名称__________、________、____________.
(2)B位于元素周期表中第______周期,第______族.
(3)C的原子结构示意图为________,C的单质与H2反应的化学方程式为_____________________________________________________________________.
(4)比较B、C的原子半径:B________C,写出A的气态氢化物与B的最高价氧化物对应的水化物反应的化学方程式__________________________________________.
解析:设A与C中间的元素原子序数为x,则A、B、C元素的原子序数分别为x-1,x+8,x+1可得x-1+x+1=x+8,x=8,为氧元素,则A为氮元素,B为硫元素,C为氟元素.
 答案:(1)氮 硫 氟 (2)三 ⅥA
答案:(1)氮 硫 氟 (2)三 ⅥA
(3) F2+H2===2HF
(4)> 2NH3+H2SO4===(NH4)2SO4
10.(2010·江门模拟)“神舟七号”所用动力燃料之一为氢化锂“三兄弟”--LiH、LiD、LiT.有关下列叙述中正确的是 ( )
A.三种物质质子数之比为1∶2∶3
B.三种物质中子数之比为1∶1∶1
C.三种物质的摩尔质量之比为8∶9∶10
D.三种物质的化学性质不相同
解析:三种物质的质子数相等;H、D、T的中子数分别为0、1、2,所以B错误;LiH、LiD、LiT的摩尔质量分别为8 g/mol、9 g/mol、10 g/mol;H、D、T是氢的三种核素,故氢化锂“三兄弟”的化学性质相似.
答案:C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com