
2.在我国,公民参与国家管理的基础和标志是公民行使( )
A.生存权和发展权 B.对国家机关及其工作人员的监督权
C.选举权和被选举权 D.言论、出版、集会、结社、游行、示威的权利
1.国体也称国家性质,我国的国体是:( )
A.坚持民主集中制原则
B.统治阶级进行阶级统治的工具
C.中国共产党领导的多党合作和政治协商制度
D.人民民主专政的社会主义国家
21.(8分)把0.6 mol X气体和0.6 mol Y气体混合于2 L体积不变的密闭容器中,使它们发生如下反应:2X(g)+ Y(g)===nZ(g)+2W(g)。2 min末已生成0.2 mol W,若测知以Z的浓度变化表示的反应速率为0.1 mol·(L·min)-1。
计算:(1)n的值;
(2)前2min内用X的浓度变化表示的平均反应速率。
宿迁市2008-2009学年度普通中学第一次四校联考
20.(10分)下图是实验室制乙烯并进而合成1,2-二溴乙烷装置
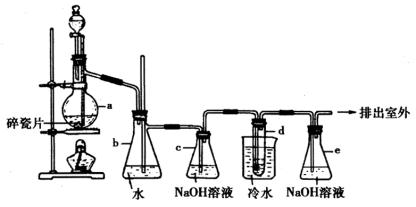
其中,a中装有乙醇和浓硫酸的混合液,d中装有液溴。填写下列空白:
(1)a中发生的化学反应为:________________。
(2)b装置的作用是:①________________,②________________。
(3)c中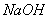 溶液的作用是________________。
溶液的作用是________________。
(4)d中发生的化学反应为:________________。
(5)1,2-二溴乙烷收率很低的原因是:①________________,②________________。
19.(10分)某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
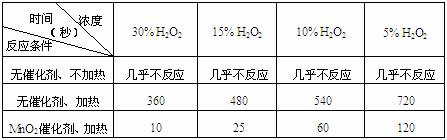
①该研究小组在设计方案时。考虑了浓度、 、 等因素对过氧化氢分解
速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响?
。
⑵将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
|
催化剂(MnO2) |
操作情况 |
观察结果 |
反应完成所需的时间 |
|
粉末状 |
混合不振荡 |
剧烈反应,带火星的木条复燃 |
3.5分钟 |
|
块状 |
反应较慢,火星红亮但木条未复燃 |
30分钟 |
①写出H2O2发生的化学反应方程式_______________ _________。
②实验结果说明催化剂作用的大小与________ ________________有关。
⑶若已知1 克液态过氧化氢分解成氧气和液态水时,可放出2.89kJ能量,写出该反应的热化学方程式: 。
18.(8分)(1)烃完全燃烧生成二氧化碳和水。若以CxHy表示任意烃,试写出CxHy完全燃烧的化学方程式:
(2)用化学方程式表示:
①苯与浓硫酸、浓硝酸混合制备硝基苯:
②乙烯与氯气的加成反应
③丙烯(CH2=CH-CH3)和溴水
。
17.(12分)下表标出的是元素周期表的一部分元素,回答下列问题:
(1)表中用字母标出的14种元素中,化学性质最不活泼的是_________________(用元素符号表示,下同),金属性最强的是_____________,非金属性最强的是 ___________,属于过渡元素的是________________(该空用字母表示)。
(2)I和F的最高价氧化物对应的水化物的化学式分别为 、 (填化学式)。
(3)除稀有气体外第三周期中原子半径最小的是_________________(填元素符号)。
(4)写出D的最高价氧化物电子式 ;D的气态氢化物的结构式 。
(5)A,F,N的氢化物中沸点最高的是 (填化学式)。
16.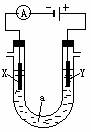 (14分)电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(14分)电解原理在化学工业中有广泛应用。右图表示一个电解池, 装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两
边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到
的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方
法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。 (说明:杂质发生的电极反应不必写出)
|
1 |
|
|
|
|||||||||||||||
|
2 |
|
|
|
|
D |
|
B |
A |
|
|||||||||
|
3 |
J |
I |
H |
|
C |
G |
F |
E |
||||||||||
|
4 |
L |
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
5 |
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15.(10分)现有①BaCl2 ②金刚石 ③ 金属铜 ④KOH ⑤干冰 ⑥固态氮气⑦二氧化硅⑧白磷⑨K2O⑩NH4Br六种物质,按下列要求回答(填序号):
⑴熔化时需要破坏共价键的是________;⑵既含有共价键又含有离子键的是 ;
⑶属于共价分子单质的是 ;⑷属于金属晶体的是_____ _______ ;
⑸写出⑤的电子式 ,
14.哈伯因发明氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生。下列有关说法正确的是
A.达到化学平衡时,N2不能完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,正反应和逆反应的速率都为零
D.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
非 选 择 题(共72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com