
1. 的倒数为( )
的倒数为( )
26. t℃时,将3molA和2molB气体通人体积为 xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
xC(气),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为O.4mol/L,请填写下列空白:
(1)x= 。
(2)比较达到平衡时,A、B两反应物的转化率:
α(A) α(B) (填>、=或<)
(3)若继续向原平衡混合物的容器中通人少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是 (填写字母序号)
A.化学平衡向正反应方向移动
B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动
D.正、逆反应的化学反应速率将发生同等程度的改变
(第四问选做6分)
(4)在t℃时,若向原平衡混合物的容器中再充人amolC,欲使达到新的平衡时,各物质的物质的量分数与原平衡相同,则至少应再充
人B mol (用含a的式子表示),达新平衡时,A的物质的量为n(A) (用含a的式子表示)
25.对于下列反应:2SO2 + O2 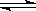 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为
。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L?min),那么2min时SO2的浓度为
。
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式 ,
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)?
假设一:
假设二:
得分
评卷人
3.0mol/L硫酸
均无明显现象(无气泡产生)
1.5mol/L硫酸
均无明显现象(无气泡产生)
3.0mol/L盐酸
少量气泡
较多气泡
大量气泡
反应剧烈
铝片耗尽
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
反应进程(分钟)
1
2
5
15
20
相同大小的铝片(纯度>99.5%)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com