
1.对本章所学的基本概念进行复习归纳。
2.熔融盐燃料电池具有高的发电效率,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气为阴极助燃气,制得在650℃下工作的燃料电池。完成有关的电池反应式:
负极反应式:2CO+2CO32--4e-→4CO2
正极反应式:
总反应式:
㈢实验题
有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入6mol·L-1H2SO4溶液中,乙同学将电极放入6mol/L的NaOH溶液中,如下图:
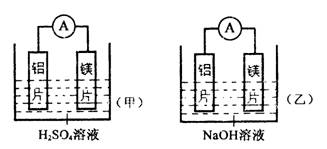
⑴写出甲池中正极的电极反应式: ;
⑵写出乙池中负极的电极反应式和总反应的离子方程式:
负极: ;
总反应的离子方程式: 。
⑶如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出 活动性更强,而乙会判断出
活动性更强(填元素符号)。
⑷由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质。
B.镁的金属性不一定比铝的金属性强。
C.该实验说明金属活动顺序表已过时,已设有实用价值。
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析。
⑸上述实验也反过来证明了“直接利用金属活动性顺序表 判断原电池中的正负极”这种做法 (可靠,或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案 (如可靠,此空可不填)。
1.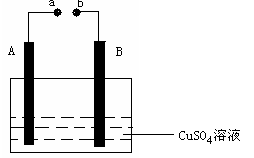 如右图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如右图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
⑴a为电源的 极。
⑵写出电极反应方程式:A ,B 。
⑶如果想使反应溶液恢复到原来状态,应该加入 ,加入 g。
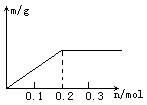
6.用Pt电极电解含有各0.1mol Cu2+和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)关系见下图,则离子的氧化能力由大到小排列正确的是
A.Cu2+>X3+>H+ B.H+>X3+>Cu2+ C.X3+>H+>Cu2+ D.Cu2+>H+>X3+
㈡填空题
5.有人设计出利用CH4和O2的反应,用铂电极在KOH溶液中构成原电池。电池的总反应类似于CH4在O2中燃烧,则下列说法正确的是( )
①每消耗1molCH4可以向外电路提供8mole- ②负极上CH4失去电子,电极反应式CH4+10OH--8e-=CO32-+7H2O ③负极上是O2获得电子,电极反应式为 O2+2H2O+4e-=4OH- ④电池放电后,溶液PH不断升高
 A.①② B.①③ C.①④ D.③④
A.①② B.①③ C.①④ D.③④
4.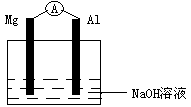 如右图所示,A为电流表,下列说法正确的是
如右图所示,A为电流表,下列说法正确的是
A.电流表A的指针不发生偏转
B.Al是原电池的负极
C.Mg逐渐溶解
D.随着反应的进行,电解质溶液的的PH值增大
3.1L 0.1mol/L的AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极上增重2.16g时,下列判断正确的是
A.电解质溶液的浓度变为0.08mol/L B.阳极上产生112mLO2(标况)
C.转移1.204×1022个电子 D.反应中有0.01mol的Ag被氧化
2.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B.2Fe+2H2O+O2=2Fe(OH)2↓
C.2H2O+O2+4e=4OH- D.Fe-3e=Fe3+
㈠选择题:
1.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极必须是两种不同的金属
B.原电池是将化学能转变为电能的装置
C.原电池中电子流出的一极是负极,该极被还原
D.原电池放电时,电流的方向是从负极到正极
电化学的学习最主要的是抓住其反应原理,从而进行判断,因此掌握实质是关键。另外适当的准确的记忆也是必要的。例如原电池中电极的反应类型、电解吃中电解质溶液中离子的放电顺序等。本专题的难点是有关电极反应的书写方法,在把握实质的基础上一定要注意电解质溶液的性质。
新型能源是近几年在考试中也日常的报道中出现频率比较高的一个词汇,而新型燃料电池就属于其中的一类,最近几年关于这一类型的考察已经明显增多。2008年的高考中,这部分内容还会出现。新型能源与传统能源的比较也是可能出现的题目。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com