
(二)词汇学习记忆困难,遗忘现象普遍
由于记忆方法运用不当,对英语单词的拼写特征不了解。许多学生每天花大量时间记单词却普遍感觉记不住。今天记住的单词过了一天就忘了,不是记不住其音就是记不住其义,更谈不上运用。部分学生感觉压力很大,学习英语的信心也受到很大影响。
经过几年的学习,大部分学生对英语有了初浅的认识,对自己在英语学习方面存在的问题也有了初步的了解。学生的英语学习动机、习惯、方法和兴趣也不尽相同。进入高中段英语学习后,由于课文内容加深,语言知识增多,尤其是词汇量的持续增加。相当一部分学生感到学习困难,突出表现在词汇学习上。据调查,当前高中生在词汇学习中存在的问题主要有以下几点:
(一)学生词汇量总体偏少
新课程标准在参考权威词频统计结果和综合了国内现行教材词汇表的基础上,适当补充了学生在日常生活、学习和交际中所需的词汇,力求与其他非英语国家的标准接轨。《课程标准》提出,高中学生在五级(初中毕业)学会使用1500-1600个单词,八级(高中毕业)累计学会使用3500个单词和400-500个习惯用语或固定搭配。调查结果表明高中新生的词汇量总体偏少大部分学生离5级目标都有一定距离,要他们在规定教学时间内达到高中英语学习目标困难较大。
21.二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
⑴ 煤的气化的主要化学反应方程式为:_____________________________________。
⑵ 煤的气化过程中产生的有害气体H2S用Na2CO3溶液吸收,生成两种酸式盐,该反应的化学方程式为:_____________________________________________。
⑶ 利用水煤气合成二甲醚的三步反应如下:
①
2H2(g)+ CO(g) CH3OH(g) ΔH = -90.8 kJmol-1
CH3OH(g) ΔH = -90.8 kJmol-1
② 2CH3OH(g) CH3OCH3(g)+ H2O(g) ΔH= -23.5
kJmol-1
CH3OCH3(g)+ H2O(g) ΔH= -23.5
kJmol-1
③ CO(g)+ H2O(g) CO2(g)+ H2(g) ΔH= -41.3 kJmol-1
CO2(g)+ H2(g) ΔH= -41.3 kJmol-1
总反应:3H2(g)+
3CO(g) CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
CH3OCH3(g)+ CO2
(g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
⑷ 已知反应②2CH3OH(g) CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400
。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+ H2O(g)某温度下的平衡常数为400
。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
20.接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:

(1)该反应450℃时的平衡常数 _____500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学 反应方程式的意义是____________.
反应方程式的意义是____________.
a. b.容器中气体的平均分子量不随时间而变化
b.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化d.容器中气体的分子总数不随时间而变化
4)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10mol
O2,半分钟后达到平衡,测得容器中含SO30.18mol,则 =______
=______ :若继续通入0.20mol SO2和0.10molO2,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
:若继续通入0.20mol SO2和0.10molO2,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
19.高炉炼铁过程中发生的主要反应

已知该反应在不同温度下的平衡常数如下:

请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(C02)= _____________、CO的平衡转化率= _____________:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe203的量 C.移出部分C02
D.提高反应温度
18。2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题:
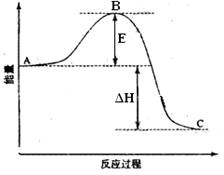
 (1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(1)图中A、C分别表示 、 ,E的大小对该反应的反应热有无影响? 。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(2)图中△H= KJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化。写出该催化循环机理的化学方程式 ;
(4)如果反应速率υ(SO2)为0.05 mol·L-1·min-1,则υ(O2)= mol·L-1·min-1、υ(SO3)= mol·L-1·min-1;
(5)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H (要求计算过程)。
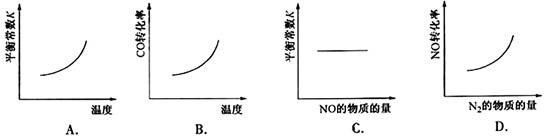
16.汽车尾气净化中的一个反应如下:
NO(g) + CO(g) 
 N2(g) + CO2(g);ΔH=-373.4 kJ·mol-1
N2(g) + CO2(g);ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是:
二:非选择题(共52分)
17,废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)用 的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
 ====
====

 ====
====

 ====
====


在 溶液中
溶液中 与
与 反应生成
反应生成 和
和 的热化学方程式为 。
的热化学方程式为 。
(2)控制其他条件相同,印刷电路板的金属粉末用10℅ 和3.0
和3.0 的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
铜平均溶解速率 (  ) ) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(3)在提纯后的 溶液中加入一定量的
溶液中加入一定量的 和
和 溶液,加热,生成
溶液,加热,生成 沉淀。制备
沉淀。制备 的离子方程式是
。
的离子方程式是
。
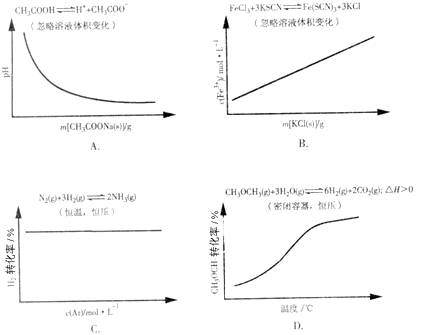
14.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
15某探究小组利用丙酮的溴代反应( )来研究反应物浓度与反应速率的关系。反应速率
)来研究反应物浓度与反应速率的关系。反应速率 通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
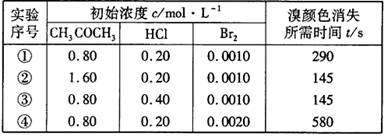
分析实验数据所得出的结论不正确的是
A.增大 增大 B.实验②和③的
增大 B.实验②和③的 相等
相等
C.增大
 增大
D.增大
增大
D.增大 ,
, 增大
增大
13.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g);ΔH=Q
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g);ΔH=Q
kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
|
|
1 |
2 |
4 |
|
100 |
1.00 |
0.75 |
0.53 |
|
200 |
1.20 |
0.90 |
0.63 |
|
300 |
1.30 |
1.00 |
0.70 |
下列说法正确的是
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
11.反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是 ( ) A.v(A)=0.4mol/(Ls) B.v(B)=0.8mol/(Ls) C.v(C)=1.2mol/(Ls) D.v(D)=0.7mol/(Ls)
12在容积一定的密闭容器中,可逆反应:
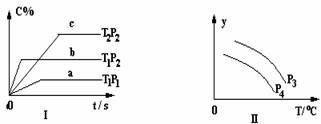
A2(g)+
B2(g) x C(g)符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法正确的是
x C(g)符合下列图Ⅰ所示关系。由此推断,对图Ⅱ的说法正确的是
A.P3>P4,Y轴表示混合气体的平均摩尔质量
B.P3<P4,Y轴表示A2的浓度
C.P3>P4,Y轴表示混合气体的密度
E P3<P4,Y轴表示A2的转化率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com