
5、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:( C )
A.10与12 B.8与17 C.11与17 D.6与14
4、下列说法正确的是:( D )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
3.下列化合物电子式书写正确的是( )


2.下列微粒电子式错误的是( B )


1.下列不是离子化合物的是( A )
A.H2O B.CaI2 C.KOH D.NaNO3
4.表示离子化合物的形成过程
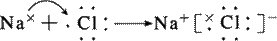
 2NaCl
2NaCl
|


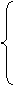
 活泼金属
M
Mn+
活泼金属
M
Mn+
|
 化合
离子键
化合
离子键
 |
 |
||||
|
|||||
 活泼非金属
X
Xm-
活泼非金属
X
Xm-
[讲]原子形成离子键以后离子间吸引和排斥作用达到平衡,成键后体系能量降低。
[板书]3.离子键的实质:阴阳离子间的静电吸引和静电排斥。
[讲]由离子键构成的化合物叫做离子化合物,所以一般离子化合物都很稳定。
[问]要想形成离子键、就必须有能提供阴、阳离子的物质,那么哪些物质能提供阴、阳离子呢?
[投影小结]
(1) 活泼的金属元素(IA,IIA)和活泼的非金属元素(VIA,VIIA)之间的化合物。
(2) 活泼的金属元素和酸根离子形成的盐
(3) 铵盐子和酸根离子(或活泼非金属元素)形成的盐。
[讲]不是只有活泼的金属元素和活泼的非金属元素之间的化合才能形成离子键,如铵离子与氯离子也能形成离子键、钠离子与硫酸根离子也能形成离子键。
[讲]含有离子键的化合物就是我们初中所学过的离子化合物。大多数的盐、碱、低价金属氧化物都属于离子化合物,所以它们都含有离子键。
[思考与交流](1)所有金属和非金属化合都能形成离子键吗?举例说明。
(2)所有非金属化合都不能形成离子键吗?举例说明。
(1) AlCl3 、AlBr3、AlI3化合物中,铝与氯之间所形成的并非离子键,均不是离子化合物
(2) NH4Cl 、NH4Br 等化合物。NH4+、CO32―、SO42―、OH―等原子团也能与活泼的非金属或金属元素形成离子键。强碱与大多数盐都存在离子键。
[板书]知识拓展------离子键的强弱比较:离子半径越小,带电荷越多,阴阳离子间作用力就越强。
[讲]与性质的关系:影响熔沸点和溶解性。例如NaCl和KCl 比较,Na+半径小于K+ ,离子键NaCl>KCl ,熔点NaCl高于KCl
[思考与交流]Cl―和Na+通过离子键形成离子化合物NaCl,那么NaCl晶体到底是不是由NaCl分子构成的呢?
在NaCl晶体中不存在NaCl分子,只有在蒸气状态时才有NaCl分子
在NaCl晶体中,每个Na+同时吸引着6个Cl―,每个Cl― 也同时吸引着6个Na+,Na+和Cl―以离子键相结合,构成晶体的粒子是离子,不存在单个的NaCl分子,晶体里阴阳离子个数比是1:1,所以NaCl表示离子晶体中离子个数比的化学式,而不是表示分子组成的分子式
[讲]由于在化学反应中,一般是原子的最外层电子发学生变化,为了分析化学反应的实质的方便,我们引进只表示元素原子最外层电子的一个式子电子式。
[板书]二.电子式
[讲]在元素符号的周围用小黑点(或×)来表示原子最外层电子的式子叫电子式。如Na、Mg、Cl、O的电子式我们可分别表示为:
|
 [板书] 1.表示原子
[板书] 1.表示原子
|
[点击试题] Al Si P S H
[讲]习惯上,写的时候要求对称。
[讲]电子式同样可以用来表示阴阳离子,例如
[板书]2.表示简单离子:
阳离子:Na+ Mg2+ Al3+


|
|
[点击试题] Ca2+ Br- K+ F –
[讲]①.电子式最外层电子数用•(或×)表示;
②.阴离子的电子式不但要画出最外层电子数,还应用[ ]括起来,并在右上角标出“n-”电荷字样;
③.阳离子不要画出最外层电子数,只需标出化合价。
[板书]3.表示离子化合物 NaF MgO KCl



Na+[∶F∶]- Mg2+[∶O∶]2- K+[∶Cl∶]-
[点击试题] KBr NaCl
[问]对于象MgCl2、Na2O之类的化合物应该如何用电子式来表示呢?
学生自己动手写,教教师在此基础上小结,说出其中的注意点
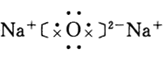

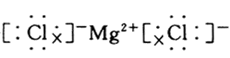

[讲]书写离子化合物的电子式时,相同离子不能合并,且一般对称排列.
[讲]对于以上我们所学习的电子式的表示是为了表示离子化合物的形成过程。
[板书]4.表示离子化合物的形成过程
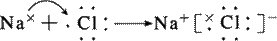

[讲]①反应物要用原子的电子式表示,而不是用分子式或分子的电子式表示;
学生成物中“同类项”,只能分写,不能合并。
②箭头表示电子转移情况,可不采用
③离子化合物形成符合质量守恒定律,连接反应物和学生成物一般用“→”
不用“====”。
[点击试题] 用电子式表示MgO和K2S的形成过程
[小结]本节课我们主要学习了化学键中的离子键及电子式的有关知识。知道离子键是阴、阳离子之间的静电作用,电子式不仅可以用来表示原子、离子,还可以用来表示物质分子及化合物的形成过程。
[自我评价]
3.表示离子化合物
2.表示简单离子:
1.表示原子
8、某元素形成气态氢化物为HnR,其最高价氧化物水化物的分子中有m个氧原子,则其最高氧化物水化物的化学式( )
A、H2m-8+nROm B、H2n-8+mROm C、H2ROm D、H2mROm
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com