
22.(7分)
将4 mol SO2与2 molO2放人4 L的密闭容器中,在一定条件下反应达到平衡:
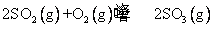 测得平衡时混合物总的物质的量为5 mol,求:
测得平衡时混合物总的物质的量为5 mol,求:
(1)平衡时各物质的物质的量浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
B卷 (满分50分)
21.(10分)
(1)右图分别是温度计、量筒、滴定管的一部分,则:
①量筒应该是 (填字母,下同),读数为 mL;
②滴定管是 ,读数为 mL;
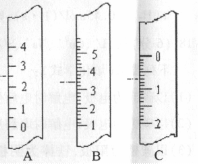 ③温度计是 ,读数是 ℃。
③温度计是 ,读数是 ℃。
(2)用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,下列实验操作对测量结果有何影响(选填“偏高”、“偏低”或“无影响”)
①滴定前滴定管尖嘴有气泡,滴定后尖嘴气泡消失 ;
②中和滴定时,锥形瓶内有少量蒸馏水 ;
③酸式滴定管用蒸馏水洗后,未用标准液润洗
④滴定管终点读数时,仰视读取刻度线 。
20.(15分)
I.A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
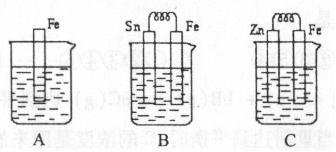
(1)A中反应的离子方程式为 ;
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”、“减小”或“不变”);
(3)C中被腐蚀的金属是 ,总反应式为 ;
比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 。
II.现有常温下的6份溶液:①0.01 mol·L-1CH3COOH溶液;②0.01 mol·L-1HCl溶液;③pH=13的氨水;④pH=13的NaOH溶液;⑤0.01 mol· L-1CH3COOH溶液与pH=12的NaOH等体积混合后所得溶液;⑥0.01 mol·L-1HCI溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)其中水的电离程度最大的是 (选填序号,下同),水的电离程度相同的是 ;
(2)若将②、④混合后所得溶液pH=12,则消耗②、④溶液的体积之比为 ;
(3)将溶液同等稀释10倍后溶液的pH:③ ④,⑤ ⑥(选填“>”或“<”或“=”)。
19.(8分)
(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填”>”或”=”或”<”),原因是(用离子方程式表示): ,实验室在配制AgNO3的溶液时为了抑制其水解,常将AgNO3固体先溶于较浓的 中,然后再用蒸馏水稀释到所需的浓度。
(2)把FeCl3溶液加热蒸干,灼烧,最后得到的主要固体产物是 ,原因是(用二个化学方程式来说明): ; 。
18.(6分)
从H+、Cu2+、Na+、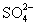 、
、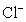 等五种离子中选择适当的离子组成电解质,使之符合下列要求(填化学式):
等五种离子中选择适当的离子组成电解质,使之符合下列要求(填化学式):
(1)以碳棒为电极,一电解时电解质质量减小,水量不变,应选用的电解质是 ;
(2)以碳棒为电极,电解时电解质质量不变,水量减少,应选用的电解质是 ;
(3)以碳棒为阳极,铁棒为阴极,电解时电解质质量和水量都减少,则应选用的电解质是 。
17.(6分)
(1)298K时,由氢气和氧气反应生成l mol水蒸气放热241.8 kJ,写出该反应的热化学方程式 。
(2)已知:①C(s)+O2(g)=CO2(g) △H=△H1;
②2CO(g)+O2(g)=2CO2(g) △H=△H2;
③TiO2(s)+2C12(g)=TiCl4(s)+O2(g) △H=△H3;
则TiO2(s)+2C12(g)+2C(s)=TiCl4(s)+2CO(g)的△H 。
(3)在一密闭容器中充人一定量的N2和H2,经测定反应开始后的2 s内氢气的平均速率:
v(H2)=0.45mol/(L·s),则2 s末NH3的浓度为 。
16.在一密闭容器中,可逆反应aA(g)+bB(g) cC(g)达到平衡后,保持温度不变,将容器容积缩小为原来的l/2,当重新达到平衡时,C的浓度是原来的1.5倍。下列说法正确的是
cC(g)达到平衡后,保持温度不变,将容器容积缩小为原来的l/2,当重新达到平衡时,C的浓度是原来的1.5倍。下列说法正确的是
A.平衡向正反应方向移动 B.C的质量分数增加
C.A的转化率降低 D.a+b=c
15.下列溶液:①pH=0的盐酸(至)0.5 mol·L-1盐酸③0.1 mol·L-1的NH4Cl溶液④0.1 mol·L-1的NaOH溶液 ⑤0.5 mol·L-1的NH4Cl溶液,以上溶液中由水电离的c(H+)由大到小的顺序是
A.⑤③④②① B.①②③⑤④ C.①②③④⑤ D.⑤③④①②
14.被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内是离子”流过”水和氧化锌组成的电解液。电池总反应为:
Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当0.1mol Zn完全溶解时,流经电解液的电子个数为1.204×1023
D.电池正极反应式为: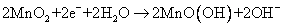
13.下列说法中,正确的是
A.△H>0表示放热反应,△H<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.l mol H2SO4与1mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com