
6.观察者站在铁路旁听火车的汽笛声,在火车驶来的过程中,观察者接收到的频率
A.比波源频率大 B.比波源频率小 C.不变 D.无法确定
5.一个人站在水面平静的湖边,观察离岸一段距离的水下的一条鱼。这个人看到的鱼的位置和鱼在水下真实位置相比较,下述说法中正确的是
A.在鱼真实位置的正下方某处
B.在鱼真实位置上方的某处
C.在鱼真实位置下方偏向观察者的某处
D.所给条件不足,无法确定观察到的鱼的位置
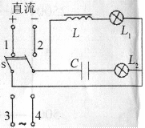
4.某同学在研究电容、电感对恒定电流与交变电流的影响时,采用
了如图所示的电路,其中L1、L2是二个完全相同的灯泡,已知把开
关置于3、4时,电路与交流电源相通,稳定后的二个灯泡发光亮度
相同,则该同学在如下操作中能观察到的实验现象是
A.当开关置于1、2时,稳定后L1、L2两个灯泡均发光且亮度也相同
B.当开关置于l、2时,稳定后L1、L2两个灯泡均发光,但L1比L2亮
C.当开关置于3、4时,稳定后若只增加交流电的频率,二个灯泡的亮度将同时变暗
D.当开关置于3、4时,稳定后若只增加交流电的频率,灯泡L2比L1亮
3.两个单摆,甲的固有频率为2f,乙的固有频率为3f,当它们均在频率为4f的同一驱动力作用下作受迫振动时
A.甲的振幅较大,振动频率为2f B.乙的振幅较大,振动频率为4f
C.甲的振幅较大,振动频率为4f D.乙的振幅较大,振动频率为3f
2.下列说法中正确的是
A.电磁场是电场和磁场的统称
B.麦克斯韦提出电磁场理论并预言电磁波的存在,若干年以后他通过实验证实了电磁波的存在
C.在变化的磁场周围一定存在变化的电场
D.电磁场是周期性变化的电场和磁场交替产生而形成的不可分割的统一体
1.一个理想变压器,原线圈和副线圈的匝数分别为n1和n2,正常工作时输入和输出的电压、电流、功率分别为U1和U2、I1和I2、P1和P2.已知n1>n2则
A.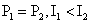 B.
B.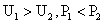 C.
C.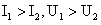 D.
D.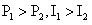
26.(13分)
氮及其化合物在生产、生活和科技等方面有重要的应用,请回答下列问题:
(1)氮元素基态原子的价电子排布式为 ;
(2)在氮气分子中,氮原子之间存在着
个 键和 个
键和 个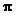 键;
键;
(3)磷、氮、氧是周期表中相邻的三种元素,比较:(均填“大于”、“小于”或“等于”)
①氮原子的第一电离能 氧原子的第一电离能;
②N2分子中氮氮键的键长 白磷分子中磷磷键的键长;
(4)氮元素的氢化物(NH3)是一种易液化的气体,请阐述其原因是 ;
(5)配合物[Cu(NH3)4]Cl2中含有4个配位键,若用2个N2H4代替其中的2个NH3,得到的配合物[Cu(NH3)2(N2H4)2]Cl2中含有配位键的个数为 。
厦门市2008-2009学年第二学期
25.(10分)
用50 mL 0.50mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液,在如图所示的装置中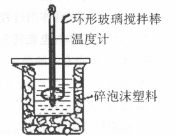 进行中和反应,测定强酸与强碱反应的反应热。
进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
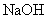 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L一的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 。
24.(15分)
工来合成氨与制备硝酸一般可连续生产,流程如下:
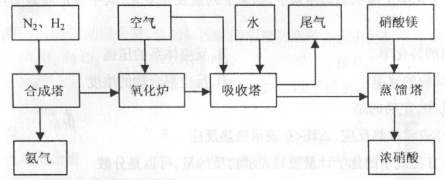
(1)工来生产时,制取氢气的一个反应为: ,
,
①t℃时,往l L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol·L-1,该温度下此反应的平衡常数K= ;
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率 (H2O)=
。
(H2O)=
。
|
T(K) |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(2)合成塔中发生反应为:

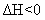
右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
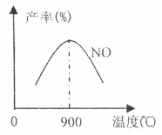
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
 (5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)  H=-574kJ·mol-1。;
H=-574kJ·mol-1。;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)  H=-1160 kJ·mol-1;
H=-1160 kJ·mol-1;
则甲烷直接将NO2还原为N2的热化学方程式为: 。
23.(12分)
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子。
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6 L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com