
2.在四棱锥的四个侧面中,直角三角形最多可有 ( )
A.4个 B.2个 C.3个 D.1个
1.已知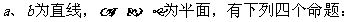
①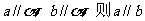 ②
②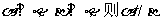
③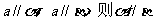 ④
④
其中正确命题的个数是
A.0 B.1 C.2 D.3
3、根据对角线规则,下列物质的性质具有相似性的是 ( )
A、硼和硅 B、铝和铁 C、铍和铝 D、铜和金
2、已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A、X与Y形成化合物是,X可以显负价,Y显正价
B、第一电离能可能Y小于X
C、最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D、气态氢化物的稳定性:HmY小于HmX
1、电负性的大小也可以作为判断金属性和非金属性强弱的尺度下列关于电负性的变化规律正确的是 ( )
A.周期表从左到右,元素的电负性逐渐变大
B.周期表从上到下,元素的电负性逐渐变大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
5、下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素
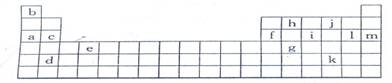
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响。
原子核失去核外不同电子所需的能量(KJ·mol-1)
|
|
锂 |
X |
Y |
|
失去第一个电子 |
519 |
502 |
580 |
|
失去第二个电子 |
7 296 |
4 570 |
1 820 |
|
失去第三个电子 |
11 799 |
6 920 |
2 750 |
|
失去第四个电子 |
|
9 550 |
11 600 |
①通过上述信息和表中的数据分析,为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 。
②表中X可能为13种元素中的 (填写字母)元素。用元素符号表示X和j形成的化合物的化学式 。
③Y是周期表中 族的元素的增加,I1逐渐增大。
④以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
解析:(1)从所给元素在周期表中的位置不难知道a、c、d、f分别为Na、Mg、Sr和Al,e处于过渡元素区也一定为金属,它们都是电的良导体;h为碳元素,其单质中的石墨也是电的良导体,故应选①、④两组。
(2)①锂原子核外共有3个电子,其中两个在K层,1个在L层,当失去最外层的一个电子后,锂离子达到稳定结构,根据题给信息可知,锂离子再失去电子便会形成不稳定结构,因此锂原子失去第二个电子时所需能量远大于失去第一个电子所需的能量。②由表中数据可知:X失去第二个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需能量皆不足前者的两倍,故第一个电子为最外层的1个电子,而其他几个电子应处于内层。结合所给的周期表知,X应为a,即钠元素,和j即氧元素所形成的化合物化学式分别为:Na2O和 Na2O2。③由表中所给Y的数据可知,Y失去第一、二、三个电子所需能量差别不大,而失去第四个电子所需能量远大于失去第三个电子所需的能量,因此,Y元素的最外层有3个电子,即为第ⅢA族的元素Al。④从题目所给信息知道,原子失电子所需能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定失电子所需能量越高,在所给13种元素中,处于零族的m元素已达8e-稳定结构,因此失去核外第一个电子需要的能量最多。
答案:(1)①④ (2)①Li原子失去1个电子后形成稳定结构,再失去1个电子很困难 ②a;Na2O 或Na2O2 ③ⅢA ④ m
教 案
|
课题:第二节 原子结构与元素的性质(3) |
授课班级 |
|
||||||||||||||||||||||||||||
|
课 时 |
|
|||||||||||||||||||||||||||||
|
教 学 目 的 |
知识 与 技能 |
1、了解元素电负性的涵义,能应用元素的电负性说明元素的某些性质 2、能根据元素的电负性资料,解释元素的“对角线”规则。 3、能从物质结构决定性质的视角解释一些化学现象,预测物质的有关性质 4、进一步认识物质结构与性质之间的关系,提高分析问题和解决问题的能力 |
||||||||||||||||||||||||||||
|
过程 与 方法 |
|
|||||||||||||||||||||||||||||
|
情感 态度 价值观 |
|
|||||||||||||||||||||||||||||
|
重 点 |
电负性的意义 |
|||||||||||||||||||||||||||||
|
难 点 |
电负性的应用 |
|||||||||||||||||||||||||||||
|
知 识 结 构 与 板 书 设 计 |
3、电负性 (1) 键合电子:元素相互化合时,原子中用于形成化学键的电子称为键合电子 孤电子:元素相互化合时,元素的价电子中没有参加形成化学键的电子的孤电子。 (2)定义:用来描述不同元素的原子对键合电子吸引力的大小。 (3)意义:元素的电负性越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性越小,相应原子在化合物中吸引电子的能力越弱。 (4) 电负性大小的标准:以F的电负性为4.0和Li的电负性为1.0作为相对标准。 (6) 元素电负性的应用 1 元素的电负性与元素的金属性和非金属性的关系 2 电负性与化合价的关系 ③判断化学键的类型 4对角线规则:元素周期中处于对角线位置的元素电负性数值相近,性质相似。 |
|||||||||||||||||||||||||||||
|
教学过程 |
||||||||||||||||||||||||||||||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|||||||||||||||||||||||||||||
|
[复习]1、什么是电离能?它与元素的金属性、非金属性有什么关系? 2、同周期元素、同主族元素的电离能变化有什么规律? [讲]元素相互化合,可理解为原子之间产生化学作用力,形象地叫做化学键,原子中用于形成化学键的电子称为键合电子。电负性的概念是由美国化学家鲍林提出的,用来描述不同元素的原子对键合电子吸引力的大小(如图1-22)。电负性越大的原子,对键合电子的吸引力越大。 [投影]   [板书]3、电负性 (1) 键合电子:元素相互化合时,原子中用于形成化学键的电子称为键合电子 孤电子:元素相互化合时,元素的价电子中没有参加形成化学键的电子的孤电子。 [讲]用来表示当两个不同原子在形成化学键时吸引电子能力的相对强弱。鲍林给电负性下的定义是“电负性是元素的原子在化合物中吸引电子能力的标度”。 [板书](2)定义:用来描述不同元素的原子对键合电子吸引力的大小。 (3)意义:元素的电负性越大,表示其原子在化合物中吸引电子的能力越强;反之,电负性越小,相应原子在化合物中吸引电子的能力越弱。 [讲]鲍林利用实验数据进行了理论计算,以氟的电负性为4.0和锂的电负性为1。0作为相对标准,得出了各元素的电负性(稀有气体未计),如图l-23所示。 [板书](4) 电负性大小的标准:以F的电负性为4.0和Li的电负性为1.0作为相对标准。 [思考与交流]同周期元素、同主族元素电负性如何变化规律?如何理解这些规律?根据电负性大小,判断氧的非金属性与氯的非金属性哪个强? [讲]金属元素越容易失电子,对键合电子的吸引能力越小,电负性越小,其金属性越强;非金属元素越容易得电子,对键合电子的吸引能力越大,电负性越大,其非金属性越强;故可以用电负性来度量金属性与非金属性的强弱。周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小。 [投影] 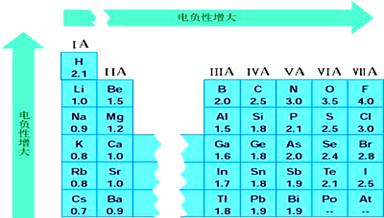 [讲]同周期元素从左往右,电负性逐渐增大,表明金属性逐渐减弱,非金属性逐渐增强。同主族元素从上往下,电负性逐渐减小,表明元素的金属性逐渐减弱,非金属性逐渐增强。 [板书](5) 元素电负性的周期性变化 1 金属元素的电负性较小,非金属元素的电负性较大。 2同周期从左到右,元素的电负性递增;同主族,自上而下,元素的电负性递减,对副族而言,同族元素的电负性也大体呈现出这种变化趋势。 [讲]电负性大的元素集中在元素周期表的右上角,电负性小的元素位于元素周期表的左下角。 [科学探究]根据数据制作的第三周期元素的电负性变化图,请用类似的方法制作IA、VIIA元素的电负性变化图。 [投影]电负性的周期性变化示例 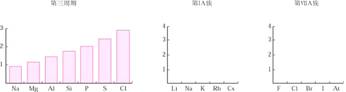 [讲]元素的电负性用于判断一种元素是金属元素还是非金属元素,以及元素的活泼性。通常,电负性小于2的元素,大部分是金属元素;电负性大于2的元素,大部分是非金属元素。非金属元素的电负性越大,非金属元素越活泼;金属元素的电负性越小,金属元素越活泼。例如,氟的电负性为4,是最强的非金属元素;钫的电负性为0.7,是最强的金属元素, [板书](6) 元素电负性的应用 1 元素的电负性与元素的金属性和非金属性的关系 [讲]金属的电负性一般都小于1.8,非金属的电负性一般都大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性在1.8左右,它们既有金属性,又有非金属性。 [讲]利用电负性可以判断化合物中元素化合价的正负;电负性大的元素易呈现负价,电负性小的元素易呈现正价。 [板书]2 电负性与化合价的关系 [讲]电负性数值的大小能够衡量元素在化合物中吸引电子能力的大小。电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值;电负性数值大的元素在化合物中吸引电子的能力强,元素的化合价为负价 [板书]③判断化学键的类型 [讲]一般电负性差值大的元素原子间形成的主要是离子键,电负性差值小于1.7或相同的非金属原子之间形成的主要是共价键;当电负性差值为零时,通常形成非极性键,不为零时易形成极性键。当电负性差值大于1.7,形成的是离子键 [点击试题]已知元素的电负性和元素的化合价等一样,也是元素的一种基本性质。下面给出14种元素的电负性:
已知:两成键元素间电负性差值大于1.7 时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键。 ①根据表中给出的数据,可推知元素的电负性具有的变化规律是 。 ②.判断下列物质是离子化合物还是共价化合物? Mg3N2 BeCl2 AlCl3 SiC 解析:元素的电负性是元素的性质,随原子序数的递增呈周期性变化。据已知条件及上表中数值:Mg3N2电负性差值为1.8,大于1.7,形成离子键,为离子化合物;BeCl2 AlCl3 SiC电负性差值分别为1.3、1.3、0.8,均小于1.7,形成共价键,为共价化合物。 答案:1.随着原子序数的递增,元素的电负性与原子半径一样呈周期性变化。2.Mg3N2;离子化合物。SiC,BeCl2、AlCl3均为共价化合物。 [板书]4对角线规则:元素周期中处于对角线位置的元素电负性数值相近,性质相似。 [科学探究] 在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,被称为“对角线规则”。查阅资料,比较锂和镁在空气中燃烧的产物,铍和铝的氢氧化物的酸碱性以及硼和硅的含氧酸酸性的强弱,说明对角线规则,并用这些元素的电负性解释对角线规则。 [讲]Li、Mg在空气中燃烧产物分别为Li2O、MgO,Be(OH)2、Al(OH)3均为两性氢氧化物,硼和硅的含氧酸均为弱酸,由此可以看出对角线规则的合理性。Li、Mg的电负性分别为1.0、1.2,Be、Al电负性均为1.5,B、Si的电负性分别为2.0、1.8数值相差不大,故性质相似.) [讲]除此之外,我们还要注意电离能和电负性间的关系。通常情况下,第一电离能大的主族元素电负性大,但IIA族,VA族元素原子的价电子排布分别为ns2,ns2np3,为全满和半满结构,这两族元素原子第一电离能反常大。 [小结]原子半径、电离能、电负性的周期性变化规律:在元素周期表中同周期元素从左到右,原子半径逐渐减小,第一电离能逐渐增大(趋势),电负性逐渐增大。在元素周期表中同主族从上到下原子半径逐渐增大,第一电离能逐渐减小,电负性逐渐减小。 [随堂练习] 4.能够证明电子在核外是分层排布的事实是( ) A、电负性 B、电离能 C、电子亲和能 D、电势能 解析:各级电离能逐级增大,I1,I2,I3。。。。。外层电子只有一个电子的碱金属元素很容易失去一个电子变为+1价阳离子,而达到稳定结构,I1较小,但再失去一个电子变为+2价阳离子却非常困难。即I2突跃式升高,即I2》I1,又如外层只有两个的Mg、Ca等碱土金属元素,I1和I2差别较小,但失去2个电子达到稳定结构后,在失去电子变为+3价阳离子却非常困难,即I3突跃式变大,I3》I2>I1,因此说电离能是核外电子分层排布的实验佐证。答案:B 3、下列原子的价电子排布中,对应于第一电离能最大的是( ) A、ns2np1 B、ns2np2 C、ns2np3 D、ns2np4 解析:当原子轨道处于全满、半满时,具有的能量较低,原子比较稳定,电离能较大。答案:C 2.下列说法正确的是( ) A.第3周期所含的元素中钠的第一电离能最小 B.铝的第一电离能比镁的第一电离能大 C.在所有元素中,氟的电离能最大 D.钾的第一电离能比镁的第一电离能大 解析:考查元素第一电离能的变化规律,一般同周期从左到右第一电离能逐渐增大,碱金属元素的第一电离能最小,稀有气体最大故A正确C不正确;但有反常,第ⅢA和VA族元素比同周期相邻两种元素第一电离能都低。同主族从上到下元素的第一电离能逐渐减小。,由于核外价电子排布镁为3S2,Al为3S23P1,故Al的第一电离能小于Mg的,所以B错误;根据同主族同周期规律可以推测:第一电离能K<Ca<Mg,所以D错误。答案:A 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |