
2、照分散系微粒直径大小不同,将分散系分为浊夜,胶体和溶液。。一般地说,溶液分散质粒子小于1nm,浊液中离子通常大于100nm,介于1nm-100nm的为胶体。胶体主要性质有:丁达尔现象、布朗运动等。
[练习] 1.胶体的本质特征是
A、 达尔现象 B、微粒带电 C、微粒直径为10-9-10-7 m D、布朗运动
1、化合反应指两种或两种以上的物质生成一种物质的反应,有些属于氧化还原反应,有些属于非氧化还原反应。
分解反应指一种物质分解生成两种或两种以上其它物质的反应,有单质生成的分解反应是氧化还原反应,有些分解反应属于非氧化还原反应。
置换反应指一种单质和一种化合物生成另一种单质和另一种化合物的反应。置换反应都是氧化还原反应。
复分解反应指的是两种化合物相互起反应生成另外两种化合物的反应,发生复分解反应的条件是:有气体,沉淀或难电离物生成。这里的复分解反应主要指的是离子交换反应,不属于氧化还原反应。
2、胶体分散系及性质
[交流]经过交流相互补充、完整。
[投影] 四种基本反应与氧化还原反应的关系
1、物质的分类(用不同方法对常见物质及化学反应的分类)
2.氧化还原反应与四种基本反应类型的关系。
|
课堂小结 |
 |
||
|
作业布置 |
1、P42-P43 1-11题 2、同步练习11 |
||
|
作业反馈 |
|
||
|
教学反思 |
|
||
|
教研组意见 |
|
签名 |
|
西安高级中学课堂教学教案
高 一 年级 5、9、11、12班 学科 化学
|
授课时间 |
2008年10 月 17 日 |
教材版本 |
必
修 |
第一册 |
||||
|
授课人 |
柴荣增 |
|
||||||
|
课 题 |
第二章化学物质及变化归纳与整理 |
课 型 |
复习课 |
第
1 课时 |
||||
|
教学目标 |
知识技能 |
1、巩固物质的分类及方法,了解胶体的主要性质。 2、进一了解离子反应的本质及离子方程式书写。 |
||||||
|
过程与方法 |
通过复习理解电解质和非电解质的概念、通过练习掌握电离方程式、离子方程式的书写方法。 |
|||||||
|
情感、态度价值观 |
1、举例说明生产、生活中常见的离子反应,关注与化学有关的社会热点问题,逐步形成可持续发展的思想。 2、养成勇于实践、不断创新的科学态度,体会学习科学探究的基本方法。 |
|||||||
|
重点难点 |
离子反应的本质及离子方程式书写。 |
|||||||
|
|
||||||||
|
课前准备 |
学法 |
从看书、记忆、作业练习、归纳、整理交流、总结掌握物质分类、离子反应。 |
||||||
|
教法 |
通过整理、归纳、探讨、交流、讲练结合,使学生掌握物质分类、
电解质的概念、离子反应。 |
|||||||
|
实验 |
无 |
|||||||
|
教具 |
多媒体课件 |
|||||||
|
板书设计 教学思路 |
1、 物质分类的两种方法。 2、 分散系、分散质、分散剂、及分类的两种方法。 3、 胶体的制法、结构和性质。 4、 电解质和非电解质的定义及内涵和外延。 5、]书写离子方程式中应记忆的六种气体是一种难电离的物质和66种物质的溶解性。 6、两种书写离子方程式的方法练习。 7、复分解型离子反应发生的条件:生成沉淀、气体或难电离的物质(弱酸、弱碱、水等),即向着离子浓度减小的方向进行。 |
|||||||
教学过程:
[归纳整理]一、
3、分析下列氧化还原反应中化合价的变化,指出氧化剂和还原剂
(1)2Fe+3Cl2 2FeCl3 氧化剂_________ 还原剂___________
2FeCl3 氧化剂_________ 还原剂___________
(2)2Al+3H2SO4=Al2(SO4)3+3H2↑ 氧化剂_________ 还原剂___________
(3) 2KClO3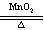 2KCl+3O2↑ 氧化剂_________ 还原剂___________
2KCl+3O2↑ 氧化剂_________ 还原剂___________
|
课堂小结 |
第三节 氧化还原反应 一、从电子得失的观点分析 二、从化合价升降的观点分析 1.氧化反应: 1.氧化反应: 2.还原反应: 2.还原反应: 3.氧化剂: 3.氧化剂: 4.还原剂: 4.还原剂: 5.氧化产物: 5.氧化产物: 6.还原产物 6.还原产物 |
||
|
作业布置 |
1、P38 1、2、3、4、5、6、7、8、9、10 2、同步练习11 |
||
|
作业反馈 |
|
||
|
教学反思 |
|
||
|
教研组意见 |
|
签名 |
|
西安高级中学课堂教学教案
高 一 年级 5、9、11、12班 学科 化学
|
授课时间 |
2008年10 月
13 日 |
教材版本 |
必
修 |
第一册 |
||||
|
授课人 |
柴荣增 |
|
||||||
|
课 题 |
第三节氧化还原反应 |
课
型 |
新授课 |
第
2 课时 |
||||
|
教学目标 |
知识技能 |
使学生了解氧化、还原反应及氧化剂和还原剂。 |
||||||
|
过程与方法 |
根据实验事实了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。 |
|||||||
|
情感、态度价值观 |
在理解电子得失、氧化和还原的相互依存和相互对立的关系上对学生进行对立统一等辩证唯物主义观点的教育。 |
|||||||
|
重点难点 |
氧化、还原反应及氧化剂和还原剂 |
|||||||
|
氧化、还原反应及氧化剂和还原剂 |
||||||||
|
课前准备 |
学法 |
从氯化钠和氯化氢两例子入手掌握氧化还原的特征和本质。 |
||||||
|
教法 |
通过观看课件、举例、讲解、练习、归纳氧化还原的特征和本质。 |
|||||||
|
实验 |
无 |
|||||||
|
教具 |
多媒体课件 |
|||||||
|
板书设计 教学思路 |
二、氧化还原反应 1、概念:(1)氧化反应及还原反应 失电子→化合价升高→ 氧化反应,如 C→CO2 得电子→ 化合价降低→ 还原反应,如CuO→Cu (2)氧化剂及还原剂 失电子物质-还原剂。 得电子物质-氧化剂。 (3)氧化产物-被氧化得到的产物。还原产物-被还原得到的产物。 2、氧化还原反应的特征:反应前后元素的化合价发生了变化。 氧化还原反应的实质:电子的转移(得失或偏移) 失电子(或电子对偏离)→化合价升高→氧化反应 得电子(或电子对偏向)→化合价降低→还原反应 ↓ ↓ ↓ (本质) (特征) (反应) 3、氧化还原反应与四种基本反应类型的关系。 |
|||||||
教学过程:
[提问]1、氧化还原反应定义
2、下列基本反应类型中,一定是氧化还原反应的是 ( )
A、化合反应 B、分解反应 C、置换反应 D、复分解反应
2、是否只有得失氧的反应才是氧化还原反应?
[反问]若从化合价变化来分,应怎样对化学反应分类?
[学生举例回答]一类是化合价有变化的反应,一类是化合价没有变化的反应。
如:CaCl2+Na2CO3=CaCO3+2NaCl等。
[板书]

[练习] 1、下列反应中,属于氧化还原反应的是( )。
A、CaCO3受热分解放出CO2 B、以MnO2为催化剂,KClO3分解放出O2
C、铁与稀硫酸反应 D、2Na+Cl2 2NaCl
2NaCl
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com