
总体设计:两段都精彩,但第三段是全文的主体,重点赏析,第二段略化处理。此步骤重在点拨。
具体作法:
1.第二段动词运用精当,从中选定三个词代表性地 赏析。(此为点)
赏析。(此为点)
2.首尾问题设计
A在表达上首尾很相似,是不是重复?(由此判断提问引入下面问题)首尾各有什么好处?(采用电脑限时学生抢答方式,调动思维的积极性,形成教学的第一个高潮。)
B首尾部分与文章主体有什么联系?(以此引导学生体会本文一线贯穿的特点。) 小结:全文紧紧围绕\'惊诧于绿\',既摇曳多姿,又缝合紧密,结构极其精巧。
小结:全文紧紧围绕\'惊诧于绿\',既摇曳多姿,又缝合紧密,结构极其精巧。
预期效果:本部分虽有一定难度,但在教师的恰当引导下,学生能够体会出本文构思的精巧所在。
总体设计:千字短文,内容充实,立意深刻,没有缜密的布局是不行的,赏析的关键是抓重点,引导得法。
赏析重点是第二段和首尾,以简明的问题引导。
具体作法:
1.第二段问题设计(落实难点)A文章描写对象是绿,在首段点题后,第二段却先写梅雨瀑、梅雨亭,直到第三段才写到梅雨潭的绿,这不游离主题吗?不会使文章显得拖沓吗?(由以上两个判断提问引入下面的主要问题)B如果不是,有什么作用?这样写与直接就写绿效果有什么不同?(以此引导学生体会本段对主体的铺垫和衬托作用,感受散文行文洒脱的特点。)
教学程序
2.知识目标:结合散文教学特点和本文 的特点,本节课要让学生在赏析中体会布局谋篇的技巧和写景的生动含情。
的特点,本节课要让学生在赏析中体会布局谋篇的技巧和写景的生动含情。
 3.能力目标:
3.能力目标: 素质教育的目的归根到底是要培养全方位的人材,就语文教学而言,既要培养学生的读写听
素质教育的目的归根到底是要培养全方位的人材,就语文教学而言,既要培养学生的读写听 说能力,也要培养学生的思维能力和文学鉴赏能力。而后两者正是本节课的能力目标。
说能力,也要培养学生的思维能力和文学鉴赏能力。而后两者正是本节课的能力目标。
1.德育目标:《绿》写于1924 年,当时朱先生还保持着\'五四\'时期青年人勇于进取的势头,文中洋溢着积极向上的情感,因此应当引导学生体会作者热爱自然热爱生活的激情,促使学生保持健康、乐观和进取的心态。
年,当时朱先生还保持着\'五四\'时期青年人勇于进取的势头,文中洋溢着积极向上的情感,因此应当引导学生体会作者热爱自然热爱生活的激情,促使学生保持健康、乐观和进取的心态。
2.铵态氮肥--铵盐
(1)物理性质:铵盐都是晶体,都易溶于水。
(2)化学性质:
①受热分解:
NH4Cl  NH3 Ÿ+ HClŸ;
NH3 Ÿ+ HClŸ;
NH4HCO3 NH3 Ÿ+ H2O
+ CO2Ÿ
NH3 Ÿ+ H2O
+ CO2Ÿ
②与碱的反应:制NH3和检验NH4+
(NH4)2SO4+2NaOH Na2SO4+2NH3Ÿ+2H2O
Na2SO4+2NH3Ÿ+2H2O
NH4NO3 + NaOH NaNO3+ NH3Ÿ+H2O
NaNO3+ NH3Ÿ+H2O
2NH4Cl+Ca(OH)2 NH3↑+CaCl2+2H2O(实验室制取氨气的反应原理)
NH3↑+CaCl2+2H2O(实验室制取氨气的反应原理)
③NH4+的检验方法:加浓碱液,加热,放出可使湿润的红色石蕊试纸变蓝的气体。
NH4++OH- NH3↑+H2O
NH3↑+H2O
注意: (1)①硝酸与任何金属反应无H2生成;②常温下,Fe、Al遇浓硝酸钝化,但在加热条件下,Fe、Al能溶解在硝酸中;③除Au、Pt外,硝酸能溶解大部分金属。
(2)比较浓H2SO4与硝酸的氧化性,例如:与Cu反应的条件,浓度对氧化性的影响(稀HNO3能与Cu反应而稀H2SO4不能)。同时指出,尽管HNO3浓度越稀,被还原程度愈大,但浓HNO3的氧化性比稀HNO3的要强,因为氧化性强弱是指氧化其他物质的能力,而不是指本身被还原的程度,即不能以还原产物中氮的价态作衡量氧化性强弱的标准。
1.氨
(1)物理性质:无色、有刺激性气味气体;易液化,液氨作致冷剂;极易溶于水(1:700)。
(2)化学性质:
①与水的反应:
NH3 +H2O
 NH3·H2O
NH3·H2O
 NH4+ + OH-(一水合氨的水溶液即氨水,显弱碱性)
NH4+ + OH-(一水合氨的水溶液即氨水,显弱碱性)
NH3·H2O
 NH3Ÿ + H2O(一水合氨不稳定)
NH3Ÿ + H2O(一水合氨不稳定)
②与酸的反应:
NH3 + HCl ==NH4Cl;2NH3 + H2SO4 == (NH4)2SO4
③与O2的反应--氨的催化氧化(接触氧化)
4NH3 +
5O2 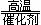 4NO +6 H2O
4NO +6 H2O
(二)硝酸
1.物理性质:无色、易挥发、有刺激性气味的液体。
2.化学性质--特性
(1)不稳定性--保存硝酸装在棕色瓶,放在冷暗处。
4HNO3 2H2O + 4NO2Ÿ + O2Ÿ
2H2O + 4NO2Ÿ + O2Ÿ
(2)强氧化性
①与金属(除Au、Pt)反应:
Cu +4HNO3(浓)==Cu(NO3)2 +2NO2Ÿ +2H2O
3Cu+8HNO3(稀)==3Cu(NO3)2 + 2NOŸ + 4H2O
常温下,浓硝酸、浓硫酸可使铁、铝表面形成致密的氧化膜而钝化,保护内部的金属不再跟硝酸反应,所以可以用铝质或铁质容器盛浓硝酸。
②与非金属反应--非金属主要生成高价的含氧酸
4HNO3 +C 2H2O + 4NO2 Ÿ+ CO2Ÿ
2H2O + 4NO2 Ÿ+ CO2Ÿ
6HNO3 + S H2SO4 + 6NO2
Ÿ+2H2O
H2SO4 + 6NO2
Ÿ+2H2O
(一)硫酸
1.硫酸的物理性质:
纯硫酸是无色油状液体,难挥发,易吸水,能与水任意比互溶,溶于水放出大量热。
2.硫酸的化学性质:
 1)稀硫酸具有酸的通性。 ①能与活泼金属反应生成盐和氢气;
1)稀硫酸具有酸的通性。 ①能与活泼金属反应生成盐和氢气;
②能与金属氧化物反应生成盐和水;
③能和碱反应生成盐和水;
④能使酸碱指示剂变色;
⑤能和某些盐反应。
 2)浓硫酸的特性: ①吸水性:将物质中含有的水分子夺去。
2)浓硫酸的特性: ①吸水性:将物质中含有的水分子夺去。
如:使蓝色的胆矾晶体变为白色固体。
②脱水性:将别的物质中的H、O按原子个数比2:1脱出生成水。
 如:
如:
 HCOOH
CO + H2O
HCOOH
CO + H2O
C12H22O11 12C + 11H2O
 ③强氧化性: a) 活泼性在H以后的金属反应:(条件:Δ)
③强氧化性: a) 活泼性在H以后的金属反应:(条件:Δ)
Cu + 2H2SO4(浓)== CuSO4 + SO2 ↑ +2H2O
b) 与非金属反应:(条件:Δ)
C + 2H2SO4(浓)== CO2 ↑+ 2SO2↑ + 2H2O
c) 冷的浓H2SO4使Fe、Cr、Al等金属表面生成
一层致密的氧化物薄膜而发生“钝化”;
d) 与其他还原性物质反应:
2HBr + H2SO4(浓)== Br2 + SO2↑ + 2H2O
H2S + H2SO4(浓)== S + SO2↑ + 2H2O
“黑面包实验”中,硫酸体现出的性质:脱水性(使蔗糖炭化)、强氧化性(有刺激性气味气体产生)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com