
酸雨及其防治:
(1)成因:含硫化石燃料的燃烧以及化工厂排放出的尾气中含有二氧化硫,在氧气和水蒸气的共同作用下,形成酸雾,随雨水降落就成为酸雨。
(2)危害:使湖泊的水质变酸,导致水生生物死亡;酸雨浸渍土壤、会使土壤变得贫瘠;长期的酸雨侵蚀会造成森林大面积死亡;酸雨危害人体健康。
(3)防止方法:①从实际情况出发,对酸性物质的排放加以控制;②改变能源结构,开发利用新能源,从根本上解决问题。
注意:SO2也有漂白性,注意与氯水的漂白性的区别
|
|
SO2 |
氯水(Cl2通入水溶液中) |
|
漂白原因 |
SO2能与某些有色物结合成不稳定无色物 |
Cl2与H2O反应生成HClO具有强氧化性,将有色物氧化成无色物 |
|
漂白效果 |
不稳定,加热能复原 |
稳定 |
|
漂白范围 |
某些有机色质 |
绝大多数有机色质 |
|
与有机色质 作用实例 |
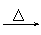 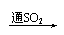 品红 褪色 红色 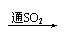 紫色石蕊 红色 |
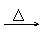  品红 褪色 不显红色  紫色石蕊 先变红随即褪色 |
|
混合作用 |
SO2+Cl2+2H2O=H2SO4+2HCl 漂白作用大大减弱 |
放电化合:N2
+O2  2NO(无色,有毒,与血红蛋白结合)
2NO(无色,有毒,与血红蛋白结合)
NO易被氧化:2 NO + O2 == 2 NO2(红棕色,有毒,刺激呼吸器官)
NO2易溶于水:3NO2 + H2O ==2HNO3 + NO(NO2不是HNO3的酸酐)
NO、NO2是大气污染物,NO2能造成光化学烟雾。
(1)物理性质:无色有刺激性气味的有毒气体,密度比空气大,易液化,易溶于水(1:40),是大气的主要污染物,来源于含硫燃料(如煤)的燃烧。
(2)化学性质
①酸性氧化物通性:
SO2+2NaOH=Na2SO3+H2O
SO2+H2O=H2SO3(可逆反应,H2SO3为中强酸)
SO2+CaO=CaSO3(煤中加生石灰防大气污染)
SO2+CaSO3+H2O=Ca(HSO3)2
②氧化性:SO2+2H2S=3S↓+2H2O
③还原性:2SO2+O2=2SO3(工业制H2SO4)
SO2+X2+2H2O=H2SO4+2HX (X2包括Cl2、Br2、I2)
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
SO2使KMnO4(H+)、Br2水,褪色也是SO2还原性表现,不是漂白性。
④SO2的漂白性→SO2与某些有色物质(如品红)结合生成不稳定的无色化合物。加热又恢复原来的颜色。
(1)常见阴离子的特性及检验
|
离子 |
检验试剂 |
主要实验现象 |
离子方程式及说明 |
|
Cl- |
AgNO3溶液,稀硝酸 |
生成的白色沉淀不溶于稀HNO3 |
Ag++Cl-===AgCl↓(白色) |
SO |
可溶性钡盐溶液,稀盐酸 |
生成不溶于稀HCl的白色沉淀 |
Ba2++SO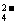 ===BaSO4↓(白色) ===BaSO4↓(白色) |
CO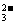 |
①BaCl2溶液、稀盐酸 ②盐酸、石灰水 |
①生成的白色沉淀能溶于稀HCl ②生成能使石灰水变浑浊的无色气体 |
①Ba2++CO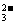 ===BaCO3↓(白色) ===BaCO3↓(白色)BaCO3+2H+===Ba2++CO2↑+H2O ②CO 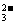 +2H+===CO2↑+H2O +2H+===CO2↑+H2OCa(OH)2+CO2===H2O+CaCO3↓(白色) |
|
OH- |
①无色酚酞试液 ②紫色石蕊溶液 ③甲基橙溶液 ④pH试纸 |
①变红色 ②变蓝色 ③变黄色 ④显蓝至深蓝色 |
OH-表现碱性 |
(2)常见阳离子的特性及检验
|
离子 |
检验试剂 |
主要实验现象 |
离子方程式及说明 |
|
Ba2+ |
硫酸或硫酸盐溶液,稀硝酸 |
加SO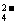 生成白色沉淀,再加稀HNO3沉淀不溶解 生成白色沉淀,再加稀HNO3沉淀不溶解 |
Ba2++SO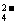 ===BaSO4↓(白色) ===BaSO4↓(白色) |
|
Mg2+ |
NaOH溶液 |
生成白色沉淀,当NaOH过量时沉淀不溶解 |
Mg2++2OH-===Mg(OH)2↓(白色) |
|
Al3+ |
NaOH溶液 氨水 |
加氨水或适量NaOH溶液,有絮状白色沉淀生成,沉淀能溶于NaOH溶液,不溶于氨水 |
Al3++3OH-===Al(OH)3↓(白色) Al(OH)3+OH-===AlO 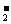 +2H2O +2H2O |
|
Fe3+(黄色) |
①NaOH溶液 ②KSCN溶液 |
①生成红褐色沉淀 ②溶液呈血红色 |
①Fe3++3OH-===Fe(OH)3↓(红褐色) ②Fe3++SCN-===(Fe(SCN))2+(血红色) |
|
Fe2+(淡绿色) |
①NaOH溶液 ②KSCN溶液, 氯水 |
①生成白色沉淀,在空气中迅速变灰绿色,最后变成红褐色 ②无明显现象,加氯水呈血红色 |
①Fe2++2OH-===Fe(OH)2↓(白色) 4Fe(OH)2+O2+2H2O==4Fe(OH)3↓ (红褐色) ②2Fe2++Cl2===2Fe3++2Cl- Fe3++SCN-===(Fe(SCN))2+ |
|
H+ |
①紫色石蕊溶液 ②橙色甲基橙溶液 ③锌片 ④pH试纸 |
①变红色 ②变红色 ③生成无色气体 ④变红色 |
H+表现酸性 ③Zn+2H+===Zn2++H2↑ |
|
Ag+ |
①盐酸或氯化物溶液,稀硝酸 ②NaOH溶液 |
①生成白色沉淀,此沉淀不溶于稀硝酸,溶于氨水 ②生成白色沉淀,迅速转变成棕色,此沉淀溶于氨水,形成无色溶液 |
①Ag++Cl-===AgCl↓(白色) AgCl+2NH3·H2O==(Ag(NH3)2)++Cl-+2H2O ②Ag++OH-===AgOH↓(白色) 2AgOH===H2O+Ag2O(棕色) AgOH+2NH3·H2O=(Ag(NH3)2)++OH-+2H2O |
注意:(1)辨清液氯和氯水的区别:
液氯:氯气在加压或冷却时变成液氯,液氯是纯净物,由Cl2分子组成,具有Cl2的化学性质;
氯水:即氯气的水溶液,属于混合物。氯气不但能溶于水,还能与水反应,氯水中的溶质有Cl2、HCl和HClO,因此氯水兼有Cl2、HCl、HClO的性质。氯水中含有的粒子包括:分子:Cl2(未反应)、H2O、HClO;离子:H+、Cl-、ClO-(HClO为弱电解质,要发生部分电离)、OH-(水电离产生的,极少量)。久置的氯水,因为HClO分解,可视为稀盐酸。
(2)干燥的氯气没有漂白性,潮湿的氯气有漂白性,这是因为Cl2与H2O反应生成的次氯酸(HClO)具有漂白性。事实上,次氯酸盐也都具有漂白性。
2.预测氯气的化学性质并用实验证实之。
氧气、氢气等都是非金属单质,由此推测:非金属一般都能跟金属反应生成盐,非金属单质间也能发生化学反应。
(1)氯气与金属的反应
2Fe+3Cl2 2FeCl3(Fe丝在氯气中燃烧,产生棕黄色烟)
2FeCl3(Fe丝在氯气中燃烧,产生棕黄色烟)
Cu+Cl2 CuCl2(Cu丝在氯气中燃烧,产生棕色烟,溶于水后,溶液呈蓝绿色)
CuCl2(Cu丝在氯气中燃烧,产生棕色烟,溶于水后,溶液呈蓝绿色)
2Na+Cl2 2NaCl(产生大量白烟)
2NaCl(产生大量白烟)
(2)氯气与非金属的反应
H2+Cl2 2HCl(H2在Cl2中能安静地燃烧,发出苍白色火焰,瓶口有白雾)
2HCl(H2在Cl2中能安静地燃烧,发出苍白色火焰,瓶口有白雾)
2P+3Cl2 2PCl3(在空气中形成白雾);2P+5Cl2
2PCl3(在空气中形成白雾);2P+5Cl2 2PCl5(在空气中形成白烟)
2PCl5(在空气中形成白烟)
(3)氯气与水的反应
Cl2+H2O==HCl+HClO(次氯酸)
氯气溶于水,在该溶液中:
①滴加酚酞溶液呈红色,说明生成了酸(H+);
②加入镁条,可观察到镁条表面有少量气泡产生,说明产生了酸(H+);
③放入红纸条,红色褪去,说明产生了一种具有漂白性的物质(HClO)。
④滴加AgNO3溶液,产生白色沉淀,说明溶液中产生了Cl-。
次氯酸不稳定,见光易分解:2HClO 2HCl+O2↑
2HCl+O2↑
(4)氯气与碱的反应
工业上制漂粉精:Cl2+2NaOH==NaCl+NaClO+H2O
工业上制漂白粉:2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O
(漂白粉的主要成分为:CaCl2、Ca(ClO)2,其有效成分为:Ca(ClO)2)
次氯酸盐跟稀酸或空气里的二氧化碳和水反应,生成次氯酸,起到漂白和消毒的作用。
NaClO+HCl==NaCl+HClO或NaClO+CO2+H2O==NaHCO3+HClO
Ca(ClO)2+2HCl==CaCl2+2HClO或Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO
1.氯气的物理性质
(1)氯气是黄绿色的气体。氯气的密度比空气大。能溶于水。
(2)有刺激性气味的气体。氯气有毒。
(闻气体方法:用手轻轻在瓶口扇动,使极少量的氯气飘进鼻孔。)
(1)物理性质:
a.硅的存在和形态:自然界中没有游离态的硅,主要以二氧化硅和硅酸盐的形式存在。
b.晶体硅是灰黑色、有金属光泽、硬而脆的固体。
c.导电性:介于导体和绝缘体之间(硅和锗是重要的半导体材料)。
(2)化学性质(和碳相似)--形成共价化合物,化学性质不活泼。
①常温下,不能强酸、强氧化性酸反应,只能与氟气、氢氟酸(HF)和烧碱等物质反应。
Si + 2F2 == SiF4 Si +4HF==SiF4 +H2↑
Si + 2NaOH+ H2O==Na2SiO3+2H2↑
②加热条件下,能跟一些非金属单质起反应。
Si + O2  SiO2
SiO2
Si + 2H2
 SiH4
SiH4
(3)工业制法:
SiO2 + 2C  Si + 2CO↑(焦炭在电炉中还原二氧化硅得到粗硅)
Si + 2CO↑(焦炭在电炉中还原二氧化硅得到粗硅)
粗硅提纯后,可以得到可用作半导体材料的高纯硅。
(3)用途:
①作半导体材料晶体管、集成电路、硅整流器和太阳能电池等;
②制合金:含硅4%的钢具有良好的导磁性--变压器铁芯;
含硅15%左右的钢具有良好的耐酸性--耐酸设备等。
注意:SiO2与CO2的比较
|
|
CO2 |
SiO2 |
|
与碱性氧化物反应 |
CaO+CO2 CaCO3 CaCO3 |
CaO+SiO2  CaSiO3 CaSiO3 |
|
与碱液反应 |
2NaOH+CO2=Na2CO3+H2O |
SiO2+2NaOH =
Na2SiO3+H2O |
|
与盐反应 |
Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓ NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3 |
2Na2CO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 Na2SiO3+CO2↑CaCO3+SiO2 CaSiO3+CO2↑ CaSiO3+CO2↑ |
|
与碳反应 |
C+CO2 2CO 2CO |
2C+SiO2 Si+2CO↑ Si+2CO↑ |
|
与H2O作用 |
CO2+H2O  H2CO3 H2CO3 |
不与水化合 |
|
与酸反应 |
不反应 |
只与HF反应 SiO2+4HF=SiF4↑+H2O |
(1)性质特征:性质稳定,熔点较高,大都难溶于水。
(2)主要原料:黏土(Al2O3·2SiO2·2H2O)、石英(SiO2)和长石(钾长石K2O·Al2O3·6SiO2或钠长石Na2O·Al2O3·6SiO2)。
(3)主要制品:玻璃、水泥、陶瓷、砖瓦、水玻璃(Na2SiO3的水溶液)等。
(4)水泥和玻璃的生产:
|
|
水泥 |
玻璃(普通) |
|
原料 |
石灰石、粘土 |
纯碱、石灰石、石英 |
|
设备 |
水泥回转窑 |
玻璃熔炉 |
|
反应 |
复杂的物理化学变化 |
Na2CO3+SiO2
 Na2SiO3+CO2↑ Na2SiO3+CO2↑CaCO3+SiO2  CaSiO3+CO2↑ CaSiO3+CO2↑ |
|
主要成分 |
3CaO·SiO2 2CaO· SiO2 3CaO·Al2O3 |
Na2O·CaO· 6SiO2 |
|
特性 |
水硬性 (加石膏调节硬化速度) |
玻璃态物质(在一定温度范围内软化) 非晶体 |
4. (10广东省24)右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。(1)主要成分碳酸钙由 三 种元素组成。
(10广东省24)右图为“хх”钙片商品标签图,请根据标签的有关信息完成下列各题。(1)主要成分碳酸钙由 三 种元素组成。
(2)碳酸钙中各元素的质量比为10∶3∶12。
(3)每片钙片中至少含钙元素的质量为0.6g。
22.(1)Fe203 (2)②
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com