
20.(10分)已知:2H2 ( g ) + O2 ( g ) = 2H2O ( l ); △H = -571.6 kJ/mol
CH4 ( g ) + 2O2 ( g ) = 2H2O ( l ) + CO2 ( g ); △H = -890 kJ/mol
标准状况下,取甲烷和氢气的混合气体11.2 L完全燃烧后恢复到常温,放出的热量为203.32kJ,试求混合气体中甲烷和氢气体积比.
19.(10分)在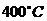 时,将
时,将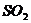 和
和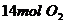 压入一个盛有催化剂的
压入一个盛有催化剂的 密闭容器中进行反应(
密闭容器中进行反应(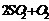
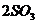 ),2分钟时容器中剩下
),2分钟时容器中剩下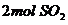 和
和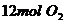 。则:
。则:
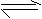 (1)2分钟内生成的
(1)2分钟内生成的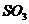 的物质的量是多少?
的物质的量是多少?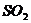 起始的物质的量是多少?
起始的物质的量是多少?
(2)2分钟内以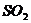 浓度变化表示的平均反应速率是多少?以
浓度变化表示的平均反应速率是多少?以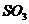 浓度变化表示的平均反应速率又是多少?
浓度变化表示的平均反应速率又是多少?
18.(8分)城市使用的燃料,现大多用煤气、液化石油气。煤气的主要成分是CO和H2的混合气体,它由煤炭和水蒸气反应制得,故又称水煤气。
(1)试写出制取水煤气的主要化学方程式____________________________.
(2)液化石油气的主要成分是丙烷,丙烷燃烧的热化学方程式为
C3H8(g)
+5O2(g) == 3CO2(g)
+ 4H2O(l);△H=–2220.0
kJ·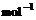 ,
,
又知CO气体燃烧的热化学方程式为:
CO(g)
+1/2O2(g) == CO2(g)
;△H=–282.57kJ·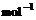 ,
,
试比较同质量的C3H8和CO燃烧,产生的热量比值约为_________:1。
(3)已知氢气燃烧的热化学方程式为2H2(g) + O2(g) ==
2H2O(l);△H=–571.6 kJ·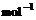 ,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
,试比较同质量的H2和C3H8燃烧,产生的热量比值约为____________:1。
(4)氢气是未来的能源,除来源丰富之外,还具有的优点是____________________
17. (8分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(8分)实验室利用如右图装置进行中和热的测定.请回答下列问题:
(1).该图中有两处未画出,它们是 、
.
(2).在操作正确的前提下,提高中和热测定准确性的关键是
____________________ .
(3).做一次完整的中和热测定实验,温度计需使用_______次.
16.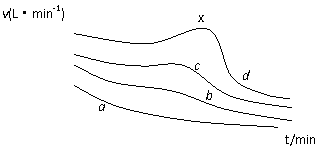 (6分)在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
(6分)在利用镁条与醋酸的反应研究化学反应速率的影响因素的实验中,同学们记录了相同体积、不同浓度的醋酸与足量Mg条反应,产生H2体积随时间变化的数据,并以单位时间内产生H2的体积来表示反应速率,其反应速率随时间变化的图(如图所示)。
(1)在a、b、c、d四条曲线中,对应醋酸溶液的物质的量浓度最小的是_________,反应最后产生的H2在相同条件下体积最大的是_____________。
(2)在d曲线中,反应一段时间以后,反应速率出现反常的升高的现象(x点附近)。产生这种现象的原因主要是____________。
15.(6分)取两支试管各加入5mL 0.1 mol/L Na2S2O3和5mL0.1molH2SO4,试管①放入冷水中,试管②放入热水中,试管_______(填①或②)中先产生明显的实验现象,离子反应方程式为_______________________________。
14.在酸性条件下H2C2O4可以被KMnO4溶液氧化,使KMnO4溶液褪色,依据KMnO4溶液褪色时间的长短可以比较反应进行的快慢。下列各组实验中溶液褪色最快的是
|
组号 |
反应温度 /℃ |
参加反应物质 |
||||
|
KMnO4 |
H2C2O4 |
MnSO4 |
||||
|
V/mL |
c/mol·L-1 |
V/mL |
c/mol·L-1 |
m/g |
||
|
A |
20 |
4 |
0.1 |
2 |
0.1 |
0 |
|
B |
20 |
4 |
0.1 |
2 |
0.1 |
0.1 |
|
C |
40 |
4 |
0.1 |
2 |
0.1 |
0 |
|
D |
40 |
4 |
0.1 |
2 |
0.2 |
0.1 |
第II卷(非选择题 58分)
13.烯烃存在顺反异构现象,已知:
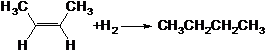
① △H=-119.6kJ/mol
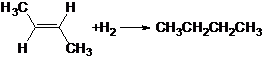
② △H=-115.6kJ/mol
下列说法中正确的是
A.上述两个反应中,反应物的总能量均低于生成物的总能量
B.上述两个反应中,破坏旧键需要的能量均大于形成新键所释放的能量
C.从上述反应热数据可知顺-2-丁烯比反-2-丁烯稳定
D.顺-2-丁烯转化为反-2-丁烯的反应热可表示为
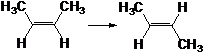 △H=-4.0kJ/mol
△H=-4.0kJ/mol
12.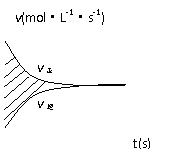 容积固定的2L密闭容器中进行的某一可逆反应
容积固定的2L密闭容器中进行的某一可逆反应
A(g)+2B(g)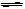 2C(g),以B的物质的量浓度
2C(g),以B的物质的量浓度
表示的反应速度υ正、υ逆与时间的关系图如所示,则图
中阴影部分的面积可表示
A.A的物质的量浓度的减少 B.B的物质的量浓度的减少
C.C的物质的量的增加 D.B的物质的量减少
11.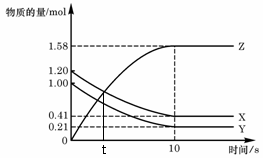 一定温度下,在2 L的密闭容器中,X、Y、Z
一定温度下,在2 L的密闭容器中,X、Y、Z
三种气体的物质的量随时间变化的曲线如右图,
下列描述正确的是
A.t秒时该反应达到各物质浓度不变状态
B.反应开始到10 s,X的物质的量浓度减
少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g) + Y(g) Z(g)
Z(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com