
29.(本题包括A、B两题,共16分)
A.(8分)有机物A和B无论以何种比例混合,其组成的混合物中所含原子的核外电子总数均不变,若A是分子中含8个氢原子的烃,B是分子中含3个碳原子的烃的含氧衍生物,试回答下列问题:
(1)若相对分子质量之差为2,试写出两组符合上述条件的A、B的组合的分子式。
①A: B:
②A: B:
(2)若相对分子质量相等,试写出一组符合题干条件的A、B的组合的结构简式。
A: B:
取
(1)请写出铜跟浓硫酸反应的化学方程式 。
(2)可以证明有余酸的实验方案可以是 。(填写字母编号,多选扣分)
A.再加入足量镁粉 B.再滴入足量BaCl2溶液
C.再加入足量银粉 D.再滴入足量Na2CO3溶液
(3)可以证明有余酸的实验方案还可以是:测定反应后混合溶液中Cu2+的量。将反应后的溶液用蒸馏水稀释至100mL,加入足量Na2S溶液,充分反应,过滤出沉淀,洗涤,干燥,称量为A克。写出生成沉淀的离子反应方程式 。如果在反应后的溶液中直接加入足量Na2S溶液,充分反应后,过滤出沉淀,洗涤,干燥,称量为B克,则B可能 A(填“>”、“<”或“=”),用化学方程式说明原因 。
(4)上述实验方案中,能够计算余酸浓度的数据除测算产生气体的物质的量或反应掉铜的物质的量外,尚缺少的测量数据是 。
28.(12分)某化学兴趣小组探究铜跟浓硫酸的反应情况:
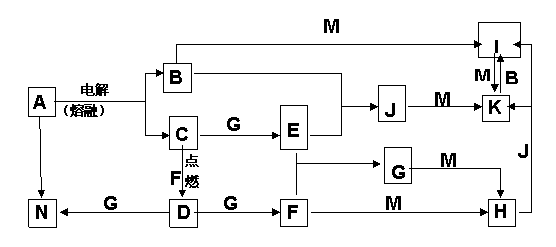
(1) H的化学式为__________ ,D的电子式 ______________________
(2)B与N反应的离子方程式为__________________________________。
(3)D与G反应的化学方程式为__________________________________。
(4)I可用于净化水,其原因为__________________________ _________ _______________________________________。(用相关的反应方程式和简要文字回答)。
(5)通常状况下,
(6)I与NaOH溶液反应生成的沉淀再与NaOH和NaClO的混合液作用,是制备理想的绿色水处理剂(Na2MO4)的一种方法,试写出此反应的化学方程式_______________________。
27.(14分)A-N均为中学化学中的常见物质,其中A是日常生活中不可缺少的物质,也是化工生产上的重要原料,单质M是目前使用量最大的金属,常温下B、E、F为气体,G为无色液体,这些物质在一定条件下存在如下转化关系,其中有些反应物或生成物已经略去。回答下列问题:
0.08
在上述条件下,n3 n4(填“>”、“<”或“=”),从反应开始直至20 s时,XO2的平均反应速率为_____mol?(L?s)-1。
③若在相同情况下最初向该容器充入的是X2O4气体,要达到上述同样的平衡状态,X2O4的起始浓度是_____________mol?L-1。
④计算③中条件下达到平衡后混合气体的平均相对分子质量:____________。(结果保留小数点后一位)。
0.08
0.05
n2
0.00
0.26
n3
n4
n(X2O4)/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com