
20.若200mLc(H+)=1×10-3mol/L的某一元酸和100mLc(OH-)=1×10-3mol/L的某一元碱溶液相混合后,溶液呈碱性,所用的酸和碱应是( ) A.等浓度的弱酸和强碱 B.稀的强酸和稀的强碱 C.稀的弱酸和浓的强碱 D.稀的强酸和浓的弱碱
19.工业上制备纯ZnCl2时,常将含杂质的氧化锌溶于过量的盐酸。为了除去杂质需调节溶液pH到4,应加入的试剂是( ) A.氨水 B.烧碱 C.氧化锌 D.氯化锌
18.某溶液中由水电离出的H+浓度为1×10-14mol/L,在此溶液中可能大量共存的离子是( ) A.Al3+、SO42-、NH4+、Cl- B.K+、Fe2+、Cl-、MnO4- C.K+、Na+、AlO2-、SO42- D.Na+、K+、NO3-、HCO3-
16.为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是( ) A.适量NaOH B.适量盐酸 C.适量KOH D.适量KHS 17.NH4Cl溶于重水(D2O)生成一水合氨和水合氢离子的化学式是( ) A.NH3·D2O和HD2O+ B.NH3·HDO和HD3O+C.NH2D·D2O和DH2O+ D.NH2D·HDO和HD3O+
15.将0.1mol·L-1醋酸溶液加水稀释,下列说法正确的是( ) A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大 C.醋酸电离平衡向左移动. D.溶液的pH增大
11.液氨与水相似,存在着微弱的电离:2NH3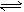 NH4++NH2-。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中正确的是( )
A.此温度下,液氨的离子积等于1×10-15
B.在液氨中放人NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
12.20℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=12,酸碱溶液混合后溶液的pH=7,则酸溶液体积V1与碱溶液体积V2的正确关系是( )
A.V1=102V2 B.V2=102V1 C.V1:2V2 D.V2=2V1
13.25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得混合液pH=10,则强酸与强碱的体积比是(假定体积不变)( )
A.1:9 B.9:1 C.1:11 D.11:1
14.关于溶液的酸碱性说法正确的是( )
A.c(H+)很小的溶液一定呈碱性
B.且pH值等于7的溶液一定呈中性
C.c(OH-)=c(H+)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
NH4++NH2-。-50℃时,两种离子的平衡浓度均为1×10-15mol/L,下列有关液氨的离子积及其电离平衡的叙述中正确的是( )
A.此温度下,液氨的离子积等于1×10-15
B.在液氨中放人NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加人NaNH2,则液氨中c(NH4+)<1×10-15mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
12.20℃时,某强酸溶液pH=a,强碱溶液pH=b,且a+b=12,酸碱溶液混合后溶液的pH=7,则酸溶液体积V1与碱溶液体积V2的正确关系是( )
A.V1=102V2 B.V2=102V1 C.V1:2V2 D.V2=2V1
13.25℃时将pH=3的强酸与pH=12的强碱溶液混合,所得混合液pH=10,则强酸与强碱的体积比是(假定体积不变)( )
A.1:9 B.9:1 C.1:11 D.11:1
14.关于溶液的酸碱性说法正确的是( )
A.c(H+)很小的溶液一定呈碱性
B.且pH值等于7的溶液一定呈中性
C.c(OH-)=c(H+)的溶液一定呈中性 D.不能使酚酞试液变红的溶液一定呈酸性
10.室温下,在pH=12的溶液中,由水电离的c(OH-)为( ) A.1.0×10-7mol/L B.1.0×106mol/L C.1.0×10-2mol/L D.1.0×10-12mol/L
9.在同一温度下,强电解质溶液a,弱电解质溶液b,金属导体c的导电能力相同,则升高温度后,它们的导电能力是( ) A.a>b>c B.a=b=c C.c>a>b D.b>a>c
8.下列事实中能证明氯化氢是共价化合物的是( ) A.氯化氢极易溶于水 B.液态氯化氢不导电 C.氯化氢不易分解 D.氯化氢溶液可以电离
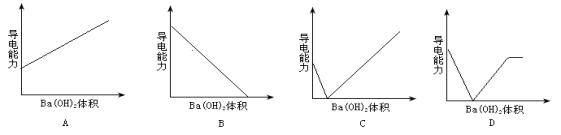
7.在lmol/L硫酸中逐滴加入lmol/LBa(OH) 2溶液,下列各图能够近似反映出溶液导电性变化的是( D )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com