
4. (2009山东卷11).元素在周围表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构,
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
[解析]碳元素在遇到不同的物质反应时,即可表现为得到电子,也可能表现为失去电子; C中H元素、Li元素不符合;第一主族的所有元素最外层都为一个电子,但是H元素与Na元素性质差异很大。
[答案]B
[考点分析]本题主要考查元素周期律的相关知识。
3.(2009广东卷1).我国稀土资源丰富。下列有关稀土元素 与
与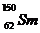 的说法正确的是
的说法正确的是
A.  与
与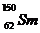 互为同位素
互为同位素
B.  与
与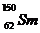 的质量数相同
的质量数相同
C.  与
与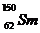 是同一种核素
是同一种核素
D.  与
与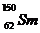 的核外电子数和中子数均为62
的核外电子数和中子数均为62
[解析]质子数相同,中子数不同的核素称为同位素,具有一定数目质子数和中子数的原子成为核素。 与
与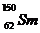 质量数不同,B错;
质量数不同,B错; 与
与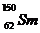 是不同核素,C错;
是不同核素,C错; 与
与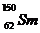 的中子数不同, D错。
的中子数不同, D错。
[答案]A
[考点分析]本题考查同位素和核素的相关概念和原子结构方面的基本计算。
2.(2009江苏高考化学8)X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是:
A.元素Y、Z、W具有相同电子层的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
D.元素W、R的最高价氧化物的水化物都是强酸
[解析]根据题意判断出5种元素分别是: X:H、Y:O、Z:Na、W:Al、R:S;
A中的离子半径是依次减小的,所以错误;
X能与Y形成化合物H2O2 ,所以B错误;
Al最高价氧化物的水化物是Al(OH)3,属于两性氢氧化物,所以D错误;
[答案]C
[考点分析]本题考查原子结构、元素的推断、元素周期律等知识。
[典例精析]
1.(2009广东卷11).元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
[解析]由题目信息可推断出,X为Na ,Y为Cl,Z为O。同周期(第三周期中)X(Na)的金属性最强,A正确;同周期元素从左向右原子半径减小,原子半径X(Na)>Y(Cl),电子层结构相同的离子,离子半径随核电荷数的增加而减小,离子半径X(Na+)<Z(O2-),B错误;同族元素中(VIA族)Z(O)的氢化物稳定性最高,C正确;同周期(第三周期中)Y(Cl)的非金属性最强,则最高价含氧酸的酸性最强(HClO4),D正确。
[答案]B
[考点分析]本题考查元素周期律的相关知识如:金属性强弱、半径大小比较、氢化物的稳定性、最高价含氧酸的酸性。
①键的极性与分子的极性。错因是混淆键的极性和分子极性的研究对象。
②晶体类型与所含元素、物质类型。晶体类型由晶体构成粒子和结合力决定,与元素种类,物质类型没有必然联系。经常互推没有因果关系的概念。
③晶体类型与分摊法:确定晶体类型时,对于原子晶体(如金刚石、二氧化硅晶体)、氯化钠、氯化铯晶体可以用分摊法。而对于分子晶体,不必用分摊法。例如,计算白磷(P)分子中化学键数,可直接根据正四面体结构计算,经常犯思维定势错误,确定分了晶体组成也用分摊法。
④晶体构成粒子内化学键与粒子间作用力。对于原子晶体、离子晶体、金属晶体,化学键与粒子间作用力类型一致;但是,对于分子晶体,一般分子内存在共价键,分子间存在分子间作用力或氢键。例如,冰由水分子靠氢键构成,而水分子内存在氢氧极性共价键。分子晶体熔融时只破坏分子间作用力,而不影响分子内化学键。稀有气体分子是单原子分子,分子内没有化学键,形成的晶体是分子晶体而不是原子晶体。经常认为粒子之间作用力都是化学键。
⑤离子晶体与分子。一般认为离子晶体不含分子,其实有一部分离子晶体中含有不能自由移动的分子。例如,蓝矾中水分子,[Ag(NH3)2]OH、[Pt(NH3)2]Cl2中含有氨分子,经常忽视特殊与一般关系。
⑥化学键与化合物类型。离子化合物一定含离子键,可能含共价键,如NaOH、Na2O2、CaC2、NH4Cl等;共价化合物一定含共价键,不含离子键。例如,H2O2,C2H2,CH3CH2CH3等,易误认为一种晶体只含一种化学键。
14.通常条件下PbSO4是一种不溶于水、酸、碱溶液的白色沉淀。但是PbSO4却溶于CH3COONH4溶液得无色溶液(1)。在(1)溶液中再通入H2S气体形成黑色沉淀(2)。结合中学化学有关离子反应发生的条件、离子反应方程式书写规则,写出(1)(2)两种产物形成的离子方程式:
(1) (2) 。
13. 已知H2CrO4是弱酸,在一饱和Ag2CrO4水溶液(含有Ag2CrO4固体)中,添加下列试剂能使c(CrO42-)减少的是
A. NH3 B. 硝酸 C. 水 D. AgNO3
12. 在BaSO3(s)  Ba2+(aq)+
SO32-(aq) 平衡体系中,下列措施可使沉淀量减少的是
Ba2+(aq)+
SO32-(aq) 平衡体系中,下列措施可使沉淀量减少的是
A. 加入K2SO3(s) B. 加入稀HNO3 C. 加入稀盐酸 D. 加入水
11.下列能够检验出KI中是否含有Br-的实验是
A. 加入足量的新制氯水,溶液变色则有Br-
B. 加入酸性KMnO4溶液,观察溶液颜色是否褪色
C. 加入少量的碘水,再加CCl4振荡,有机层有色则有Br-
D. 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br-
10.某温度下,在100ml饱和石灰水中加入少量生石灰,充分反应后恢复到原来的温度。下列判断正确的是
A. 溶液中Ca2+数目减少 B. 溶液中c(Ca2+)增大
C. 溶液的pH不变 D. 溶液中溶质的质量分数增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com