
[例13]Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为
A.1∶7 B.1∶9 C.1∶5 D.2∶9
[例14]在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A 3.0mol B 1.5mol C 1.0mol D 0.75mol
[课堂练习]
1.对于反应14CuSO4 +5FeS2 +12H2O =7Cu2S +5FeSO4 +12H2SO4 来说,下列结论正确的是
A、FeS2 既是氧化剂,又是还原剂 B、只有CuSO4 作氧化剂
C.被氧化的硫和被还原的硫质量比是3:7 D、被氧化的硫和被还原的硫质量比是1:1
4、 FeSi + HNO3 = H4SiO4 + Fe(NO3)3 + NO + H2O
3、 Na2Sx + NaClO + NaOH = Na2SO4 + NaCl + H2O
2、 FeS2 + O2 = Fe2O3 + SO2
⑴配平原则: ①标变价②列升降③求相等④观察计量数
FeCl2+ HNO3 = FeCl3+ NO + H2O+ Fe(NO3)3
②缺项确定:一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,再通过比较反应物与生成物,确定缺项(一般为H2O、H+或OH-),最后观察配平。
[例12]配平下列方程式:
1、 KClO3 + HCl = KCl + Cl2 + H2O
3.氧化性,还原性强弱的判断
(1)根据反应式或化合价判断:
[例8]判断下列反应中I2,FeCl3,Cl2,SO42-氧化性强弱顺序为 。
①I2+SO2+2H2O=2HI+H2SO4; ②2FeCl2+Cl2=2FeCl3;
③2FeCl3+2HI=2FeCl2+2HCl+I2。
(2)根据物质的活动性判断:
金属活动顺序:
非金属活动顺序:
(3)根据原电池、电解池的电极反应判断
[例9]A、B、C是三种金属,根据下列①②实验确定它们还原性强弱顺序:①将A与B浸在稀H2SO4中用导线连接,A上有气体逸出,B逐渐溶解;②电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
(4)根据反应条件判断:
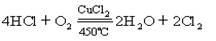
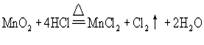
[例10]已知
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
氧化能力:KMnO4---------- MnO2----------- O2
(5)根据氧化产物价态高低判断:
(6)根据元素周期表判断:
:
(7)根据物质的浓度大小比较:
(8)根据反应热判断:
[例11]观察下列反应 H2(g)+X2(g)===2HX(g) ⊿H1<0
H2(g)+Y2(g)===2HY(g) ⊿H2<0
若⊿H1<⊿H2则X2(g) Y2(g) 氧化性强弱顺序__________, X- 、Y-还原性顺序__________
2.从元素的价态考虑:最高价态------只有 性,最低价态------只有 性,
中间价态------有 性,也有 性 。
[例7]下列变化需要加入还原剂才能实现的是( )
A、MnO4 → MnO2 B、Cl-- → Cl2 C、H2S → SO2 D、Fe2+ → Fe
1.物质氧化性还原性的强弱取决于 ,与 无关。例如钠,铝还原性强弱 。
⑴电子得失守恒规律:
[例4]用Na2SO3还原MnO4-,如果还原含有2.4×10-3molMnO4-的溶液时,消耗30mL0.2mol/LNa2SO3溶液,则Mn元素在还原产物中的化合价是( )
A、+1 B、+2 C、+4 D、+5
⑵“以强制弱”规律:
⑶价态归中规律:
[例5]在氧化还原反应KClO3+6HCl=KCl+3Cl2+3H2O中,当生成0.5molCl2时,氧化产物和还原产物的物质的量之比为___________
A、5:1 B、3:1 C、1:3 D、1:5
⑷反应先后规律:在溶液中存在几种不同的还原剂且其浓度相差不大时,加入氧化剂,还原性较强的先被氧化。同时存在几种不同的氧化剂且其浓度相差不大时,加入还原剂,氧化性较强的先被还原。
[例6]标准状况下,往100mL 0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是( )
A、0.224L B、0.336L C、0.448L D、0.672L
2、单线桥法: 2Na+2H2O=2NaOH+H2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com