
1. D 点拨:A选项中亚铁离子具有还原性;B选项中氢气与碳就为常见还原剂;C选项中忽略了歧化反应与归中反应;D选项通常会和置换反应混淆,同素异形体间的转化就不是氧化还原反应。
23.氮有多种氧化物,其中亚硝酐N2O3很不稳定,在液体或蒸气中大部分离解成NO和NO2,因而在NO转化成NO2的过程中几乎没有N2O3生成。亚硝酸也不稳定,在微热甚至常温下也会分解。亚硝酸钠是一种致癌物质,它在中性或碱性条件下是稳定的,酸化后能氧化碘化钾生成碘和NO气体。 (1)写出亚硝酸分解的化学方程式:
(2)写出酸性溶液中亚硝酸钠和碘化钾反应制取一氧化氮的离子方程式:
(3)在隔绝空气的条件下按以下操作:先向亚硝酸钠中加入稀盐酸,片刻后再加入碘化钾溶液,这样制得的气体的平均分子量 30。
.将0.04molKMnO4固体加热,一段时间后,收集到amol气体,此时KMnO4的分解率为x,在反应后的残留固体中加入足量的浓盐酸,又收集到bmol气体,此时Mn元素全部以Mn2+存在于溶液中,试回答下列问题:
①a+b= (用x表示)
②当x= 时,a+b取最小值,且最小值是 。
③当a+b=0.09时,加热后所得残留固体的质量为 克。
[解题思路点拨]
22.一个完整的氧化还原反应方程式可以拆开写成两个“半反应式”, 2Fe3++Cu=2Fe2++Cu2+拆写的结果是:氧化反应:Cu-2e=Cu2+;还原反应:Fe3++e=Fe2+,一个是“氧化反应”式,一个是“还原反应”式.如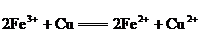 的拆写结果是:氧化反应为:
的拆写结果是:氧化反应为: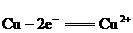 ;还原反应为:
;还原反应为: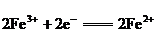 .
.
①请据此将反应: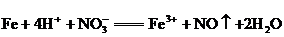 拆写成两个“半反应式”:氧化反应为____________________;还原反应为____________________.
拆写成两个“半反应式”:氧化反应为____________________;还原反应为____________________.
②已知某一氧化还原反应为: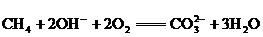 ;其中氧化反应的半反应可写为:
;其中氧化反应的半反应可写为: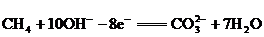 ,则还原反应的半反应可写为:_________________________.
,则还原反应的半反应可写为:_________________________.
21.三聚氰酸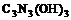 可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:
可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解: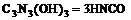 HNCO(异氰酸,其结构是H–N=C=O)能和NO2反应生成N2、CO2和H2O。
HNCO(异氰酸,其结构是H–N=C=O)能和NO2反应生成N2、CO2和H2O。
写出HNCO+和NO2反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?指出电子转移的数目?
20.氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素
[如:(SCN)2+H2O HSCN+HSCNO]。它们阴离子所谓还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
HSCN+HSCNO]。它们阴离子所谓还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
①(CN)2与KOH溶液反应的化学方程式
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式
19.实验室为监测空气中汞蒸气的含量;往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg→Cu2HgI4+2Cu
(1)上述反应产物Cu2HgI4中,Cu元素显 价。
(2)以上反应中的氧化剂为 ,当有1molCuI参与反应时,转移电子 mol。
(3)CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式。
Cu2++ I-→ CuI+ I3-
18.硫代硫酸钠可作为脱氯剂,已知25.0 mL 0.100mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A. S2- B. S C. SO32- D. SO42-
17.臭氧(O3)可使湿润的碘化钾淀粉试纸变蓝,其反应方程式为:KI+O3+H2O-KOH+I2+O2(未配平)(未配平)。由此得出的结论正确的是
A.臭氧在反应中被氧化为O2
B.O3的氧化能力比 O2强
C.1 mol O3在反应中得2 mol电子
D.氧化产物 O2与还原产物I2的物质的量之比为1:1
16.从含硒(Se)的废料中提取硒的方法之一是:用硫酸和硝酸处理废料,获得亚硒酸和少量硒酸,再与盐酸共热,硒酸转化为亚硒酸:2HCl+H2SeO4=H2SeO3+Cl2+H2O然后向亚硒酸中通入SO2,生成粗硒。进一步提纯时,可往熔融的粗硒中通入氧气,使生成的氧化硒挥发,再转变成亚硒酸,还原为单质硒。
根据上述信息,回答下列两题:
(1)对盐酸与硒酸反应的下述判断中,正确的是
A.该反应是强酸制取弱酸的复分解反应 B.硒酸发生氧化反应
C.硒酸有强氧化性 D.盐酸在反应中是氧化剂
(2)对SeO2和SO2及它们的水溶液,下列叙述不正确的是
A.SeO2和SO2均是酸性氧化物 B.SeO2和SO2均属于分子晶体类型
C.亚硫酸氧化性弱于亚硒酸 D.SO2与亚硒酸反应的物质的量比为1:1
(3)下列叙述正确的是
A.H2SeO3氧化性强于HNO3 B.亚硒酸氧化性强于H2SO3
C.二氧化硒的还原性强于二氧化硫 D.析出1mol硒,需H2SeO3、SO2各1mol
14.根据下列实验事实,判断微粒氧化性大小顺序正确的是 ①FeC13:溶液中滴入 KI溶液,加 CCl4振荡, CCl4层呈紫色 ②FeCl2溶液中滴加氨水,再加 KSCN溶液,呈红色 ③KMnO4溶液中滴加盐酸, KMnO4溶液的紫色褪去 A.I2<C12<Fe³+< MnO4¯ B. MnO4¯> C12> Fe³+>I2; C. C12>I2> Fe³+> MnO4¯ D. Fe³+> MnO4¯> C12>I2 15.电视剧《西游记》中仙境美仑美奂。这些神话仙境中所需的烟幕是用NH4NO3和Zn粉按质量比8:6.5混合放于温热的石棉网上,使用时滴水数滴即产生大量的白烟,又知发生反应后有N2和水生成。有关的说法中正确的是 ( )
A.水起着溶解NH4NO3,发生吸热现象以启动反应的作用
B.每还原1molNO3-需氧化1molZn和1molNH4+
C.成烟物质是两性氧化物小颗粒
D.成烟物质是小锌粒,它由NH4NO3反应加热而蒸出
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com