
4.在2008年北京奥运会上,两艘赛艇a、b在两条平行的直赛道上行驶.它们在四次比赛中的v一t图象如图所示,其中能够表示其所对应的比赛中有一艘赛艇始终没有追上另一艘的图象是 ( )
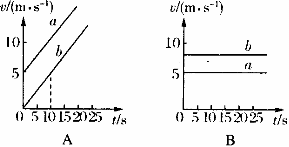
3.做匀加速直线运动的物体,依次通过A、B、C三点,位移xAB=xBC,已知物体在AB段的平均速度大小为3 m/s,在BC段的平均速度大小为6 m/s,那么,物体在B点的瞬时速度的大小为 ( )
A.4 m/s B.4.5 m/s C.5 m/s D.5.5 m/s
2.汽车进行刹车试验,若速度从8 m/s匀减速到零所用的时间为1 s,按规定速率为8 m/s的汽车刹车后位移不得超过5.9 m,那么上述刹车试验是否符合规定 ( )
 A.位移为8 m,符合规定
B.位移为8 m,不符合规定
A.位移为8 m,符合规定
B.位移为8 m,不符合规定
C.位移为4 m.符合规定 D.位移为4 m,不符合规定
1.某物体以30 m/s的初速度竖直上抛,不计空气阻力,g取10m/s2。5 s内物体的( )
A.路程为65 m B.位移大小为25 m,方向向上
C.速度改变量的大小为10 m/s D.平均速度大小为13 m/s,方向向上
34.(11分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如下图。该实验的主要操作步骤如下:
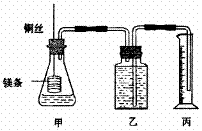
①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用 量取10.00 mL 1mol/L盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录 ;
⑥反应结束后,待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,
应将量筒缓缓上下移动,使乙、丙中液面相平,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作与观察方法: 。
(2)写出Mg与醋酸反应的离子方程式_____________________________________________。
(3)本实验中丙应选用 (填序号)的量筒。 A、100 mL B、200 mL C、500 mL
(4)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积:Vm= 。
(5)简述速率不等的原因 ,铜丝不与
酸接触的原因是 。
33.
 (12分)
(12分) 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属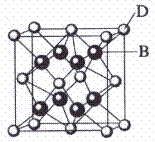 同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。 请回答:
请回答:
 (1)A元素的名称是
;
(1)A元素的名称是
;
 (2)B的基态原子轨道表示式为
,C的原子结构示意图为
,
(2)B的基态原子轨道表示式为
,C的原子结构示意图为
,
B与A形成的化合物比C 与A形成的化合物沸点高,其原因是 .
 (3)E属元素周期表中第
周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
:
(3)E属元素周期表中第
周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为
:
 (4)从图中可以看出,D跟B形成的离子化合物的电子式为
;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求带单位列出计算表达式)。
(4)从图中可以看出,D跟B形成的离子化合物的电子式为
;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求带单位列出计算表达式)。
32.(9分)右图为一定量AlCl3溶液中加入NaOH溶液后,产生Al(OH)3白色沉淀的质量与NaOH的物质的量之间的关系。试回答:
(1) A点时已参加反应的AlCl3和 NaOH的物质的
量之比为 。
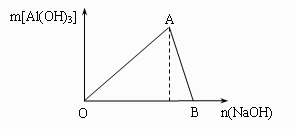
(2) OA段曲线所表示的反应的离子方程式是
___________________。AB段曲线所表示的反应的离子方程式是___________________。
(3) B处溶液中存在的浓度最大的离子是 (填离子符号)。向B处生成的溶液中通入二氧化碳,可观察到的现象是 。
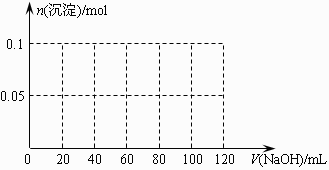
(3) 向含有0.1mol NH4Al(SO4)2溶液中逐滴加入5mol·L-1NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有刺激性气味的气体逸出;最后白色沉淀逐渐减少并最终消失。请在右图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系示意图。
31. (8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
(8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为 。(元素符号)
 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
。(化学式)
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
。(化学式)
 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式
。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式
。
 (4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

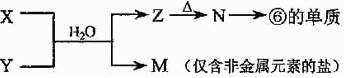
 X溶液与Y溶液反应的离子方程式为
,
X溶液与Y溶液反应的离子方程式为
,
 N→⑥ 的化学方程式为
。
N→⑥ 的化学方程式为
。
30.由短周期元素组成的中学常见无机物A、B、C、D、E、X存在如右图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 ( )
A.若A是单质,B和D的反应是OH-+HCO3- =H2O+CO32-,
则E一定能还原Fe2O3
B.若X是Na2CO3,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
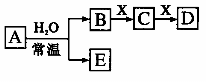 C.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
C.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
D.若D为CO,C能和E反应,则A一定为Na2O2
第II卷( 非选择题 共40分 )
29.为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g样品加热至质量不在改变,其质量变为w2g,则该样品的纯度(质量分数)是 ( )
A.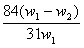 B.
B.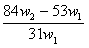 C.
C.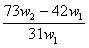 D.
D.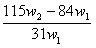

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com