
17.(8分)几种短周期元素的原子半径及其某些化合价见下表:
|
元素代号 |
A |
B |
D |
E |
G |
H |
I |
J |
|
常见化合价 |
-1 |
-2 |
+4、-4 |
+6、+4、-2 |
+5、-3 |
+3 |
+2 |
+1 |
|
原子半径/pm |
64 |
66 |
77 |
104 |
110 |
143 |
160 |
186 |
试回答以下问题(涉及上述元素的答案,请用元素符号表示)。
(1)E元素在周期表中位于 。
(2)A、H、J对应离子的半径由大到小的顺序是 。
(3)DB2的结构式 。
(4)过量的D的最高价氧化物,与一定量的J的最高价氧化物对应水化物X的溶液发生反应的离子方程式: 。
16.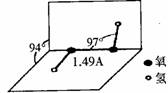 (10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。
(10分)过氧化氢是一种无色透明的无毒液体,常被称为“绿色氧化剂”。
(1)过氧化氢的分子结构如右图,则下列有关过氧化氢的说法不正确的是 。
A.过氧化氢是非极性分子
B.过氧化氢分子中既有极性键,也有非极性键
C.过氧化氢分子中的氧原子以sp3杂化方式成键
D.常压下,过氧化氢的沸点高于水
(2)过氧化氢是一种弱酸,在298 K时,它的一级电离常数为K=1.55×10-12。请写出它在水中的主要电离方程式: 。
(3)过氧化氢可作为采矿业废液的消毒剂,如用来消除采矿废液中的氰化物,反应式(已配平)如下:KCN+H2O2+H2O= A +NH3↑。则被氧化的元素是 。
(4)过氧化氧作为绿色氧化剂,常与铜和稀硫酸共同制取硫酸铜。请写出反应的离子方程式: 。
(5)过氧化氢还可用作脱氯剂,其主要反应为C12+H2O2一O2+HCl,则每有0.2 mol H2O2参加反应转移的电子数为 。
15.(12分)根据侯德榜制碱法原理,某实验小组用食盐、氨水、大理石、盐酸制取碳酸钠。其实验过程如下:
①配制含氨的氯化钠饱和溶液; ②用石灰石和稀盐酸制取纯净的CO2;
③将CO2通入NaCl的氨溶液中,保持溶液的温度为40±2℃,得到碳酸氢钠晶体;
④冷却,减压过滤,用冷水洗涤沉淀; ⑤焙烧NaHCO3得到Na2CO3;
⑥向母液中加入粉状NaCl,并冷却至0℃以下,得到NH4Cl晶体。
已知:相关物质在不同温度下的溶解度数据(g/100g水)如下表:
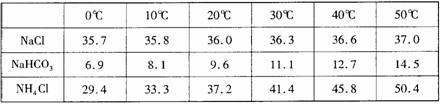
(1)侯德榜制碱法除了获得碳酸钠外,还能得到的副产品是 。
(2)过程中③中发生反应的化学方程式为 。
(3)为控制40±2℃的温度范围,采取的方法为 。
(4)判断过程④中沉淀已经洗涤干净的操作是 。
(5)加入粉状NaCl并冷却到0℃以下的目的是 。
(6)若实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
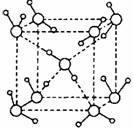
14.冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰一Ⅶ的晶体结构为一个如右图所示的立方晶胞。则下列说法正确的是
A.冰晶体熔化时需克服共价键
B.晶体中lmol水可形成1mol氢键
C.每个水分子可与周围4个水分子以氢键结合
D.H2O与H+以配位键结合成H3O+,且立体结构为三角锥形
13.由钠、镁、铝、锌四种金属单质中两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况)。此合金中一定含有
 A.钠 B.锌 C.镁 D.铝
A.钠 B.锌 C.镁 D.铝
12.粗盐因含有杂质MgCl2而易潮解。为得到纯净的氯化钠,有人设计了一个实验:把粗盐放入纯氯化钠饱和溶液恒温一段时间后,过滤,洗涤,可得纯净的氯化钠晶体。则下列说法中正确的是
A.设计实验的依据是溶解平衡原理 B.粗盐晶粒越大越有利于NaCl提纯
C.实验表明MgCl2比NaC1易溶于水 D.实验过程中NaCl溶液浓度会变大
11.已知X、Y两元素处于同一周期,且电负性X>Y,下列说法不正确的是
A.第一电离能Y一定小于X
B.X与Y形成的化合物中,X可以显负价,Y显正价
C.X最高价对应含氧酸的酸性弱于Y
D.Y形成的气态氢化物稳定性小于X
10.某同学从文献中查得下列化学方程式或离子方程式,你认为其中不正确的是
A.用烧碱溶液吸收工业制HNO3的尾气:NO+NO2+2NaOH=2NaNO2+H2O
B.用“示踪原子法”来判断反应的历程:K37C1O3+6HCl=K37C1+3Cl2↑+3H2O
C.用AgNO3溶液和氨水配制银氨溶液:Ag++2NH3·H2O=Ag(NH3)2++2H2O
D.碘化钾放置在酸性空气中被氧化变质:4I一+O2+4H+=2I2+2H2O
9.叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(1)+3N2(g)。则有关说法正确的是
A.氮气常温下稳定,是因为氮的电负性小
B.采用液化空气法分离N2和O2首先得到N2
C.钠晶胞[钾型(体心立方)]中含2个钠原子
D.NaN3与KN3结构相似,前者晶格能较小
8.光电子能谱证实:用作合成氨反应催化剂的洁净铁表面上存在氮原子。右图为氮 原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,大灰色球代表铁原子)。则在图示状况下,铁颗粒表面上N与Fe原子数比值的最大值是
A.1:1 B.1:2 C.l:3 Dl:4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com