(3)锰的电负性为1.99。Cr的电负性为1.66,说明锰的
金属性比铬_____(强、弱)
(4)最近发现钛(Ti)原子和碳原子构成气态团簇分子,分子
模型如图。则其化学式为______。它属于______晶体,
其主要物理性质____________
__________(写出2个即可)
《化学与技术》
26-28为选择题,每小题只有一个正确选项,每小题3分
△ A.无水氯化镁的制备:MgCl2?6H2O MgCl2+6H2O B.生产普通玻璃的主要原料有石灰石、石英和纯碱 C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 D.漂粉精的制备:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O
试题详情
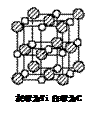 (2)Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。 (2)Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。
试题详情
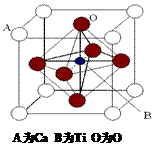
25.钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,它的应用研究是目前科学研究的前沿之一。 2007年诺贝尔物理学奖为法国科学家阿尔贝。费尔和德国科学家彼得.格林贝格尔共同获得,以表彰他们在巨磁电阻效应(MR效应)研究方面的成就,某钙钛型复合氧化物(如右图),以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有CMR效应。 (1)写出该晶体的化学式________________
试题详情
24.某有机物(名称乙烯酮)的结构简式为: CH2=C=O,下列描述正确的是( ) A.该分子中共有2个π健、2个σ健 B.该分子属非极性分子 C.该分子是直线型分子 D.该分子中2个碳原子的杂化方式是不同的
试题详情
C.任何晶体,若含阳离子也一定含阴离子 D.水分子稳定是因为水分子间存在氢键作用
试题详情
23.下列叙述中正确的是 ( ) A.一切四面体空间构型的分子内键角均为109。28, B.Cu(OH)2能溶于过量氨水形成络合物[Cu(NH3)4]2+,中心离子为Cu2+,配位体是
试题详情
22.用“等电子原理”可以判断某些分子或离子的空间构型。已知BF3的空间构型为平面三角形。下列分子或离子中,空间构型也为平面三角形的是 ( ) A.NH3 B.CO32- C.PO43- D.SO2
试题详情
| | | |
