
(4)将沉淀过滤、洗涤、烘干后,称得Mg(OH)2的质量为0.435g。又测得装置B中剩余气体的密度为氢气的10倍,体积为224ml(以上数据均折算成标准状况)。由此可推算出残渣中各物质的量之比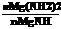 =___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。
=___________________________。然而将上述镁带燃烧过程在相同情况下重复多次。固体残渣中实际所得Mg(NH2)2和MgNH的物质的量之比总是小于该值,分析可能的原因是______________________________________________________。
 21、(B)
21、(B)
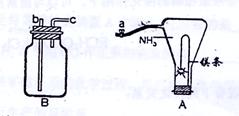
全属镁具有很强的还原性,点燃的镁条能在氨气中剧烈燃烧,发生如下反应:
①Mg+2NH3―点燃→Mg(NH2)2+H2
②Mg+NH3―点燃→MgNH+H2
(1)如上图装置A所示,镁条在HN3中燃烧时,先落下的残渣主要是Mg(NH2)2,后落下的残渣主要是MgNH。其原因是_____________________________。
(2)为了使残渣中Mg(NH2)2生成得更多,可以在镁条燃烧前打开弹簧夹a,并将导管与充满_____气体的装置B连接,连接的导管接口为________(填编号“b”或“c”),理由是_____________
(3)将固体残渣在盛有水的烧杯中加热至沸腾后,Mg(NH2)2和MgNH完全水解,产生Mg(OH)2和NH3。为了确保Mg(NH2)2和MgNH全部转化为Mg(OH)2,加热过程中必要的操作是_____________________________________________________________。
(3)已知下列元素的电负性数据:H: 2.1, O: 3.5, F:4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F一O键中共用电子对偏向F而产生的极性;②从电负性上看,
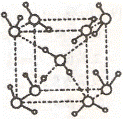
(2)水在不同的温度和压力条件下可以形成11种不同结构的晶体,密度从比水轻的
 21(A)聚合铁(简称PFS)化学式为:
21(A)聚合铁(简称PFS)化学式为: 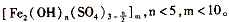 现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
现代污水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。
(l)①PFS中铁显 价,铁原子的电子排布式是 。 ②O元素的第一电离能 N 元素的第一电离能(填“大于”或“小于”) ,原因 ;水分子中氧原子的杂化轨道类型为 。H2O与H+以配位键结合成H3O+的立体结构为 。
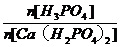 =x,试求y与x的关系式。
=x,试求y与x的关系式。
八、本题共两小题,任选一题
(3)取m g 磷灰石粉末,用50.00mL混酸溶液(磷酸为0.5mol/L、硫酸为0.1 mol/L)与其反应,结果Ca、S、P元素全部以CaSO4 和Ca(H2PO4)2 的形式存在,求m的值。
(4)若工厂用磷灰石中Ca3(PO4)2 为原料同时生产H3PO4和Ca(H2PO4)2 ,市场上1mol H3PO4的利润是a元,1 mol Ca(H2PO4)2的利润是b元。由100 mol原料Ca3(PO4)2 制得的二种产品的利润共为y元,产品H3PO4和Ca(H2PO4)2的物质的量之比
6.10
(1)磷灰石中,碳元素的质量分数为___________%(保留两位小数)。
(2)取
3.50
28.40
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com